Comprendre le varroa: le principale problème des essaims d'abeilles
Le varroa est arrivé en France en 1980. Dans tous les rapports, ce parasite est cité comme un facteur majeur d'affaiblissement des colonies. Chaque apiculteur doit donc connaître parfaitement la biologie de ce parasite.
Deux espèces de varroas existent: jacobsoni et destructor. Il existe 14 haplotypes (définis sur CO-I) de jacobsoni et 8 de destructor. Seulement l'haplotype jacobsoni Java (VJ Java), destructor Japan (VD Japan) et Korea (VD Korea) sont présents chez Apis mellifera. VJ Java n'est que temporaire chez mellifera. VD Japan et Korea ne se reproduisent que dans le couvain de faux bourdon chez cerana. Chez mellifera, ils parasitent le couvain mais aussi les abeilles adultes. L'haplotype Korea est le plus répandu dans le monde. Dans un premier temps, nous présenterons comment reconnaître ce parasite et son cycle de vie. Nous finirons par présenter les mécanismes de résistance existants.
|
1.1 Symptômes de la présence de varroas 1.1.1. Une faible activité 1.1.2. Peu de production 1.1.3. Des abeilles avec des ailes déformées 1.1.4. Des abeilles de petite taille 1.2 Morphologie de Varroa destructor 2.1 Diversité des cycles 2.2. Mécanisme d’infestation du couvain 2.3. Du mimétisme chimique tout au long de son cycle de vie |
2.4. Trophie et déplacement dans le couvain 2.5. Oviposition des fondatrices varroas 2.6. Phase phorétique des varroas 3. Mécanismes de résistance des abeilles aux varroas 3.1. L’épouillage: Grooming 3.2. Postcapping Stage Duration (PSD) 3.3. Suppressed mites reproduction 3.3.1. Varroa sensitive hygiene (VSH) 3.3.2. L’effet du couvain 3.3.3. Recapping: réoperculation 3.4. Sélection sur des marqueurs protéiques |
1. Reconnaître le varroa
1.1 Symptômes de la présence de varroa
Pour voir si une ruche a des varroas, il n’est pas nécessaire de voir directement les parasites. Différents symptômes peuvent nous alerter.
1.1.1. Une faible activité


Kralj et Fuchs ont réalisé une étude en 2006, où ils regardent les temps de retour à la ruche des butineuses en fonction de l’infestation. On peut voir que le groupe d’abeilles infestées a la médiane de retour à la ruche la plus haute mais toutes les abeilles ne semblent pas affectées. Cette latence de retour à la ruche est expliquée par un problème d’orientation des abeilles parasitées. Ces problème d’orientation avec les autres éléments que nous allons voir conduisent à une plus faible activité sur les abeilles fortement infestées.
1.1.2. Peu de production
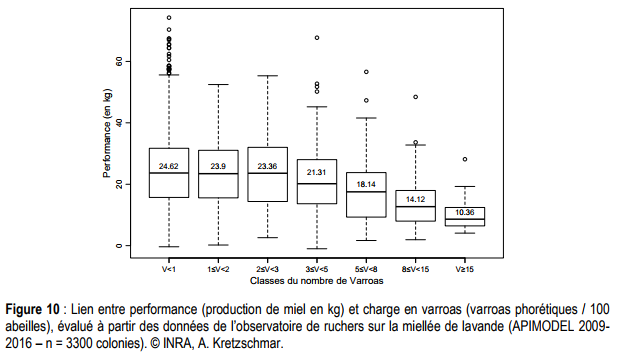
L’INRA a étudié la performance sur la production de colonies en fonction de leur charge en varroas. Cette charge a été calculée par une mesure de varroas sur les abeilles adultes. On parle de varroas phorétiques. Le diagramme ci-dessus nous indique que la pression en varroas a un impact sur la production à partir d’une infestation de 3%. Il est intéressant de noter que la production a été divisée par 2 pour les niveaux d'infestations au dessus de 15%.
1.1.3. Des abeilles avec des ailes déformées
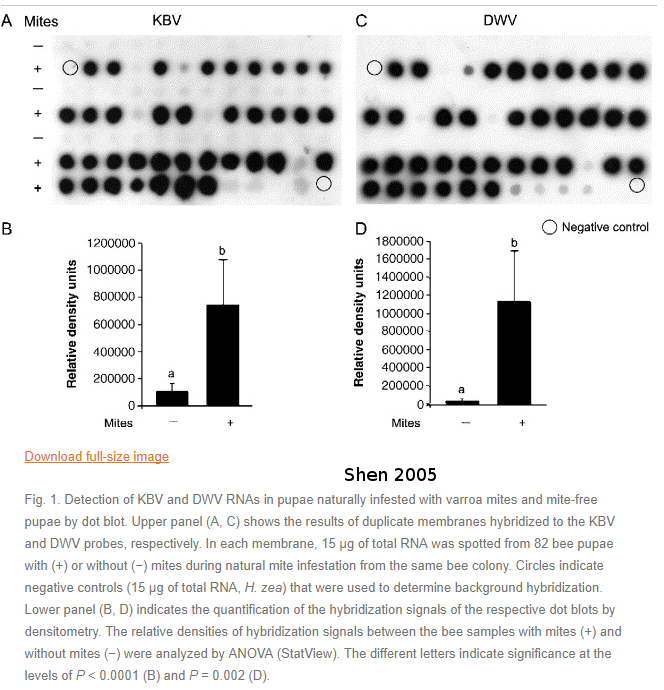
En 2005, l’étude de Shen a regardé la présence de virus comme le Kasmir Bee Virus (KBV) Deformed wing virus (DWV). Ces deux virus sont pathogènes pour les abeilles. On peut voir que la présence de varroas conduit à une forte densité de virus chez les abeilles.
La photo ci dessus montre à gauche une abeille saine et à droite une abeille infectée par le DWV. On peut voir que ce virus conduit à une forte déformation des ailes des abeilles. Ce symptôme est à l’origine de son nom. La présence de varroas va donc favoriser le DWV, ce qui va conduire à la déformation des ailes des abeilles.
1.1.4. Des abeilles de petite taille
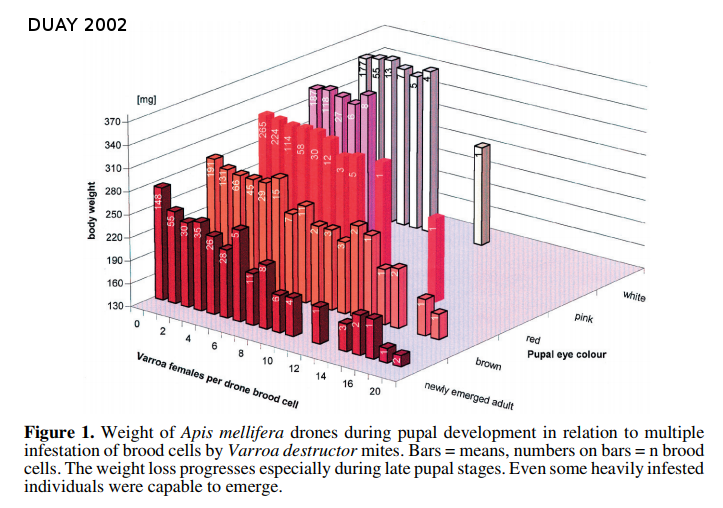
Duay en 2002 a étudié l’impact du nombre de fondatrices varroas sur le poids de nymphes d’abeilles. On peut voir sur le graphique en blanc les jeunes nymphes; plus la couleur des barres est sombre plus les nymphes sont âgées. Les valeurs de poids deviennent plus basses pour les cellules infestées par de nombreux varroas. Cet effet devient plus marqué pour les nymphes âgées. Le varroa a donc un impact sur le poids des abeilles. C’est pour cela que l’on remarque des abeilles de petite taille dans les colonies fortement infestées.
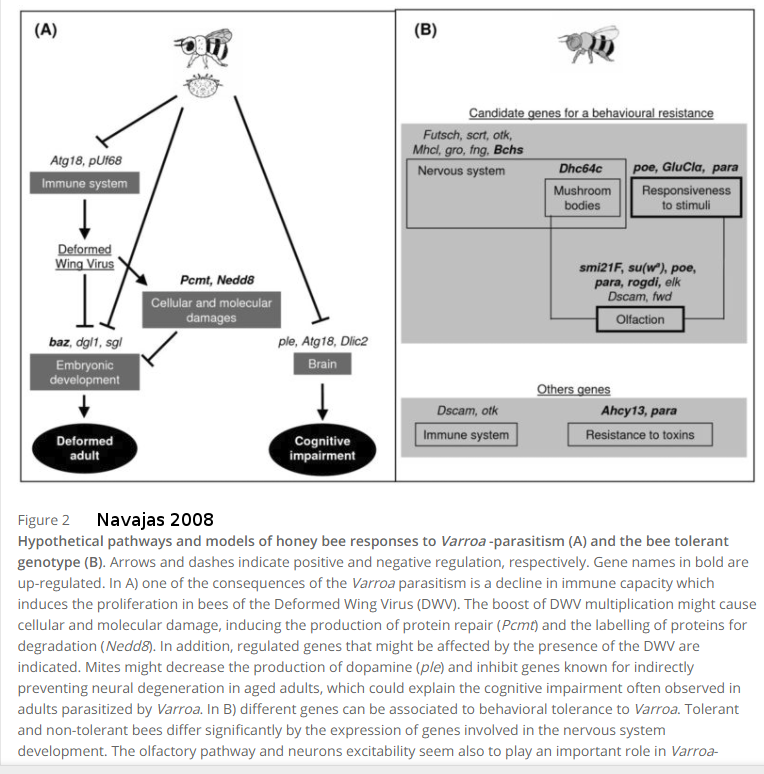
Navajas en étudiant le niveau d’expression des gènes en 2008, nous permet de comprendre l’origine des différents symptômes que nous avons vu. La présence de varroas a un impact sur le cerveau, le système immunitaire mais aussi le développement embryonnaire des abeilles. Cet affaiblissement est le terrain de développement de maladies mais aussi peut potentialiser l’effet des pesticides sur les abeilles.
1.2 Morphologie de Varroa destructor
Les femelles sont visibles sur les abeilles adultes fixées sous les tergites et les sternites. Elles ont un corps fortement sclérotisé, d'une forme elliptique aplatie, de 1170 µm sur 1700µm de large.
![]()
La photo ci-dessus nous montre que la couleur passe du brun clair au brun rougeâtre suivant l'âge.
Elles ont un grand bouclier dorsal mais plusieurs plaques ventrales. Des poils sont présents sur les différentes parties du corps.
Les mâles sont très différents. Leur corps est en forme de poire et a une couleur variable allant du jaune clair au blanc. Il ne mesure qu'entre 750 et 930 µm de long et entre 700 et 910 µm de large. Il n'est présent que dans le couvain.
Les formes immatures sont plus petites et non sclérotinisées. Il y a différents stades: l’oeuf, la protonymphe, la deutonymphe et l'adulte. Le document suivant fait un bilan de la morphologie des stades des varroas que l’on peut retrouver dans le couvain. Sur les abeilles adultes, on ne retrouve que des femelles varroas adultes.
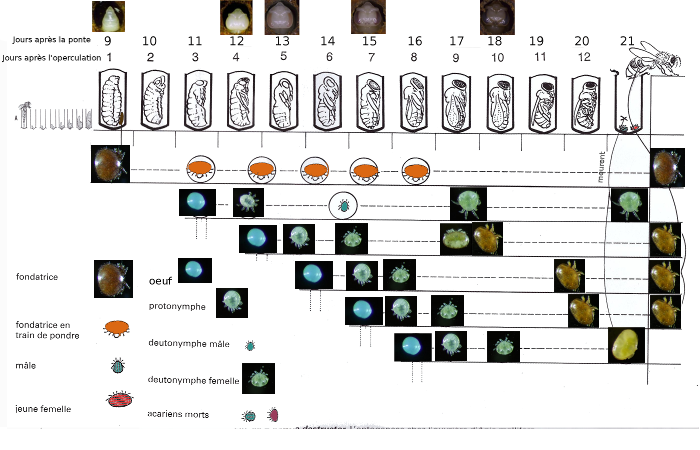
Nous pouvons voir que les varroas se reproduisent dans le couvain, ce qui va conduire à de nouveaux individus. On parle de cycle de vie. Nous allons voir maintenant plus en détail son cycle de vie.
2. Cycle biologique du varroa
2.1 Diversité des cycles du varroa
Dans la ruche, la reine, les ouvrières et les mâles n’ont pas le même cycle de développement. Nous allons voir comment cela impacte la reproduction des varroas.
La figure suivante présente le cycle de vie du varroa.
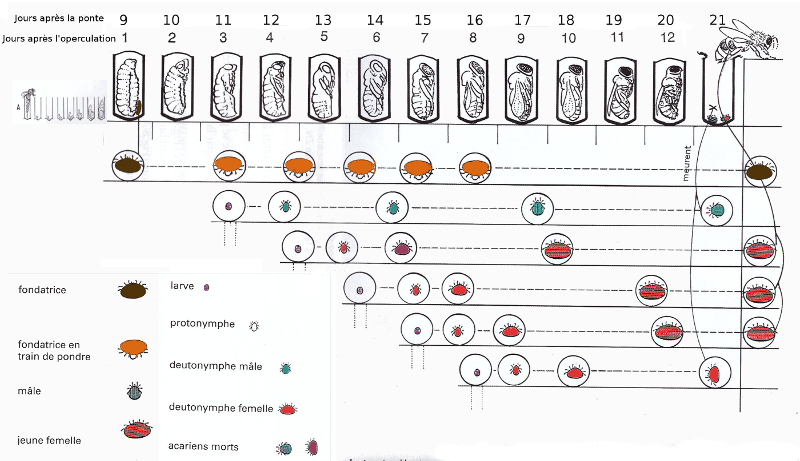
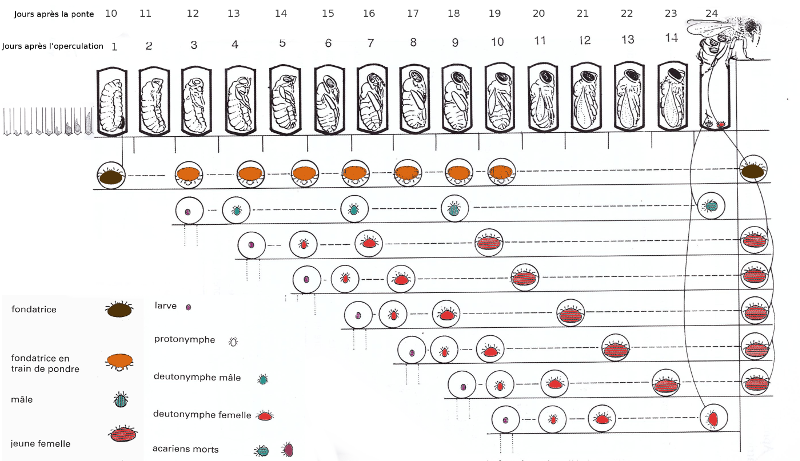
 Comme nous pouvons le voir sur la figure, une fondatrice arrive à faire 3 nouvelles fondatrices dans du couvain d'ouvrière et 5 dans du couvain de mâles.
Comme nous pouvons le voir sur la figure, une fondatrice arrive à faire 3 nouvelles fondatrices dans du couvain d'ouvrière et 5 dans du couvain de mâles.
2.2. Mécanisme d’infestation du couvain
Boot a cherché à comprendre si les varroas avaient une préférence entre le couvain de mâles et le couvain d’ouvrières. On peut voir sur le graphique qu’il a réalisé en abscisse le nombre de cellules du couvain par kilogramme d’abeilles et en ordonnées l’infestation en varroas. La pente de la droite de tendance de l’infestation du couvain de mâles est bien plus forte que celle du couvain de femelles. Les varroas vont préférentiellement dans le couvain de mâles.
Beetsma donne un éclairage en 1999 en présentant le temps pour que les varroas infestent les cellules de faux bourdons ou d’ouvrières. On peut voir que les courbes ne sont pas identiques. L’infestation de cellules d’ouvrières, représentée par des symboles vides, a lieu à partir de 20h avant l’operculation, alors que la fondatrice se glisse à partir de 40 heures avant l’operculation chez les mâles.
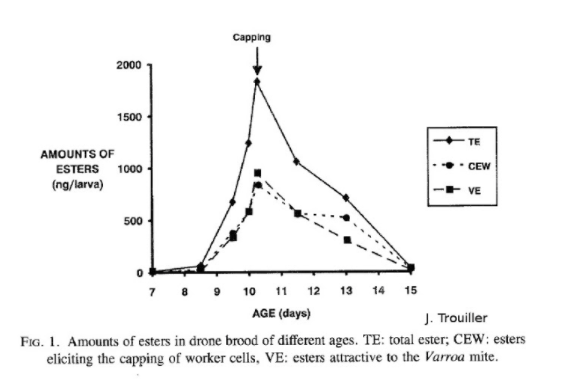
Le document présenté est une courbe de la quantité d'esters produits par larve en fonction de leur âge. Nous observons un pic d'ester le jour de l'operculation. Il s’agit de phéromones signalant l'operculation. Ces esters donnent le signal d’infestation des cellules aux varroas. Quand une substance est produite par une espèce et agit sur une autre, on parle de kairomones.
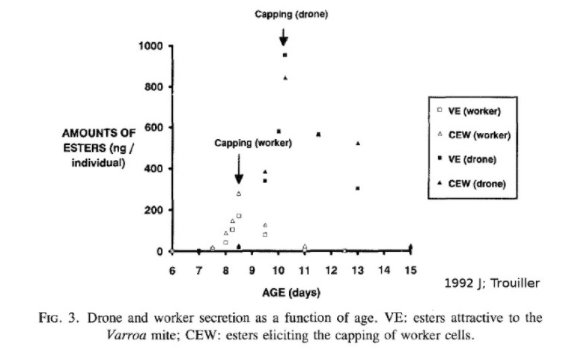
Le deuxième graphique de Trouillet présente les différents esters. On peut voir que le couvain de faux bourdons produit plus de kairomones que le couvain d'ouvrières. Ce niveau de production différent entre les couvains conduit les varroas à infester préférentiellement le couvain de faux bourdons.
Ces esters sont des signaux permettant aux nourrices de connaître quand operculer le couvain. L’utilisation de ce signal par le varroa est un joli cas d’espionnage chimique réalisé par le varroa. Par ailleurs, certains font l’hypothèse que l’inégalité de production de ces substances dans le couvain pourrait expliquer la répartition en agrégats des varroas dans le couvain.
2.3. Du mimétisme chimique tout au long de son cycle de vie
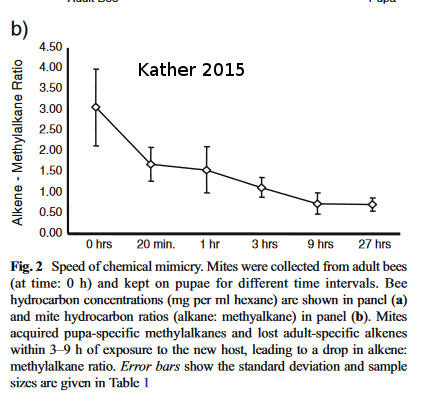
Les abeilles se reconnaissent par leurs profils en CH de leur cuticule. Comment le varroa fait-il pour échapper à la vigilance des abeilles?
Plusieurs études ont montré que le varroa pouvait être capable d’un mimétisme chimique de la colonie. L’étude de Kather est plus folle. Il a étudié les variations de profil de la méthylation des alkénes des varroas (profil CH) lorsqu’ils passent d’un adulte à une pupe. On peut voir qu’il ne faut que 9h au varroa pour changer ses méthylations. Le mimétisme chimique du varroa est donc très plastique.
2.4. Trophie et déplacement dans le couvain
Après l’infestation, la fondatrice s'immerge dans la nourriture larvaire. Entre 60 et 74 heures plus tard, le premier oeuf de mâle (haploïde) est pondu.
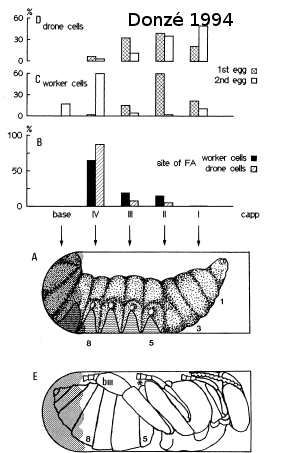
Donzé en 1994 nous présente la répartition spatiale des activités des fondatrices. Sur les graphiques D et C, on retrouve en abscisse le pourcentage d’oeufs dans les différentes parties de la cellule. On peut voir que l’oeuf de mâle (le premier oeuf) est généralement dans le haut de la cellule. Par contre, le deuxième oeuf ne semble pas avoir la même localisation entre le couvain de mâles et le couvain d’ouvrières.
Après la ponte du 1er oeuf, la fondatrice établit une zone de nourriture (perforation à la 5ème sternite) et une zone d'accumulation fécale où auront lieu les accouplements.
Donzé nous montre que cette zone d’accumulation fécale est vers le bas de la cellule mais pas au fond. Les oeufs sont ensuite pondus toutes les 30 heures. 4 à 5 femelles sont pondues. Les mâles arrivent à maturité 20 heures avant la première femelle.
2.5. Oviposition des fondatrices varroas
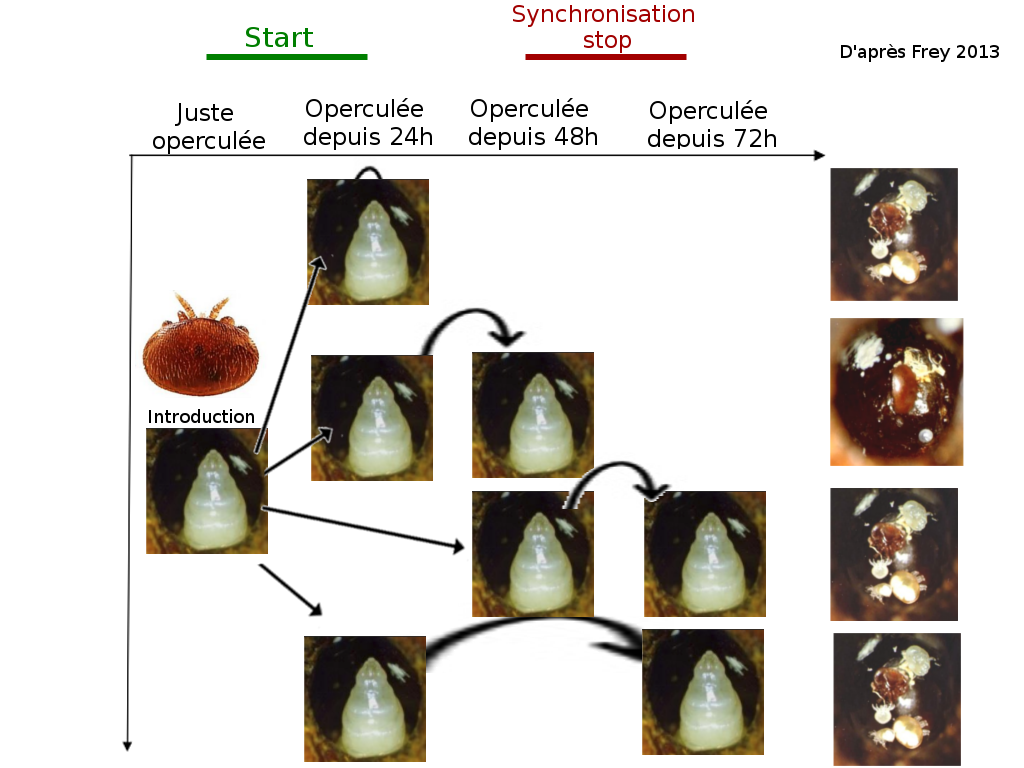
En 2013, Frey a cherché à comprendre comment était contrôlée la fécondité des varroas. Pour cela, il a mis plus où moins longtemps des varroas phorétiques dans des cellules. Suivant les groupes, les varroas ont été transférés dans des cellules de stade plus tardif pour sauter de 24 à 48h à 72h ou 24 à 72h après operculation. Il a ensuite observer leur capacité à se reproduire. On peut voir que les varroas ayant sauté le stade 24 à 48h ne sont plus fertiles, contrairement aux autres. Leur spermathèque a été analysée et est normale. A partir d’expériences complémentaires, il explique que l’oviposition du varroa est activée par un signal start durant les premières 18h de l’operculation (36h chez les mâles). Ce signal est en partie lié aux composés polaires de la cuticule des larves. Entre les 48h et 72h, il existe un signal de synchronisation qui stoppe l’oviposition si la fondatrice n’est pas synchronisée avec la larve parasite. Cette synchronisation évite à la fondatrice de dépenser inutilement de l'énergie pour sa reproduction si elle est désynchronisée par rapport à son hôte.
Lors des comptages du niveau de fécondité des varroas, on observe régulièrement des infestations multiples. Elles permettent aux différentes populations de varroas de la ruche de se croiser pour limiter la consanguinité. Cependant, ce phénomène n’a pas un impact fort sur les populations de varroas (Beaurepaire 2017) car les multi-infestations ne se font pas préférentiellement entre individus de familles différentes. La ré-infestation entre colonies semblent avoir un impact plus forte sur la structure de la population de varroas en homogénéisant la population au sein d'un rucher. Greatti a montré qu'elle était de 1.6 à 13.7 en saison et jusqu'à une moyenne de 75 varroas par jour/colonie en automne lors que le pillage est plus fort.

Par ailleurs, on remarque souvent que ces varroas sont moins fertiles. Fucks et Langerbach ont montré que la fécondité des varroas est infestation dépendante. Plus il y a des varroas dans une cellule, plus cela inhibe leur reproduction. Nassi et al. ont montré que le (Z)-8-heptadecene était en parti responsable de cette baisse de fécondité. En 2004, Milani a montré que 100 ng d’heptadécène pouvait augmenter le nombre de filles varroas mal fécondées lorsqu’il est mis sous l’opercule. Cette molécule réduit l’infestation de 41% lorsqu’elle est mise entre 0 à 16h avant l’infestation dans les cellules.
2.6. Phase phorétique des varroas
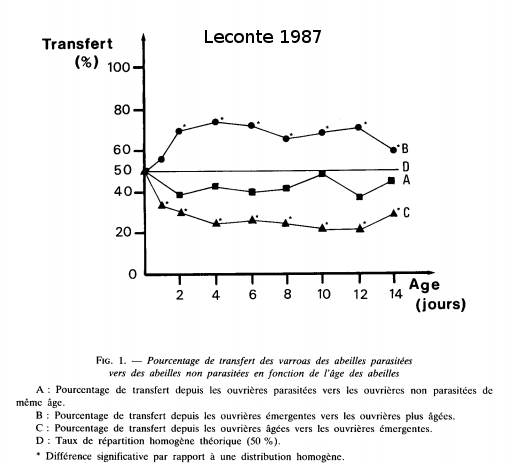
Les varroas sortent avec l’abeille adulte. Leconte a cherché si les varroas restaient sur cette abeille ou changeaient d’hôte. Le graphique de sa publication de 1987 montre que si l’on présente une abeille non parasitée à cette abeille, la chance de transfer varie suivant le type d’abeille. On peut voir que les varroas vont plus facilement vers des abeilles non parasitées plus âgées que des abeilles du même âge ou plus jeune.
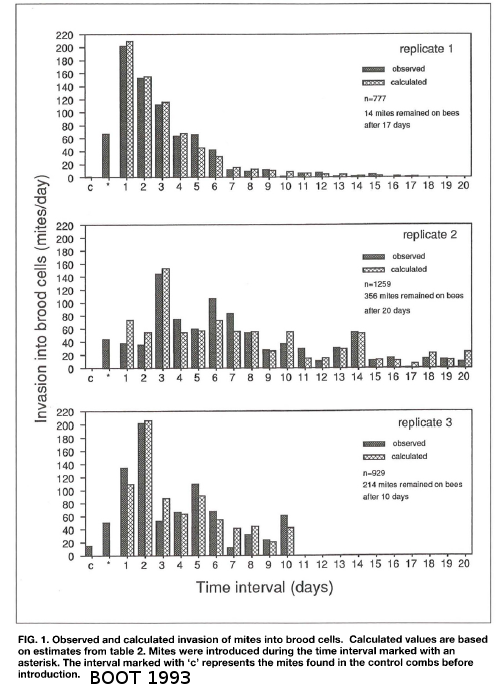
Boot en 1993 a cherché la durée que restaient les varroas sur les abeilles avant d’infester de nouveau une cellule. L’étude sur ces 3 réplicats montre qu’en moyenne les varroas prennent 2 jours à réinfester une cellule. En saison, cette période phorétique peut durer une dizaine de jours parfois. Durant l'hiver, le phase phorétique peut potentiellement durer plusieurs mois.
3. Mécanismes de résistance aux varroas
3.1.L’épouillage: Grooming

Fries en 1996 a étudié l’épouillage des abeilles, c’est à dire la capacité à faire tomber des varroas qu’on leur en a inoculé. Il a observé que les Apis cerana (résistantes aux varroas) on un épouillage plus fort que les Apis mellifera. Par ailleurs, le varroa ne semble pas capable de regagner l’essaim sans aide. V. destructor a une moyenne de survie de 71 heures en présence d’abeilles mortes, de 21 heures sans substrat. Des essaims de sélection ont été faits sur des abeilles mais l’héritabilité faible de ce caractère a conduit à des résultats décevants.
3.2. Postcapping Stage Duration (PSD)
Les abeilles africaines ont une durée d'operculation plus faible que les abeilles europeein. Büchler & W. Drescher ont voulu vérifier l'effet de cette durée sur l'infestation en varroa.
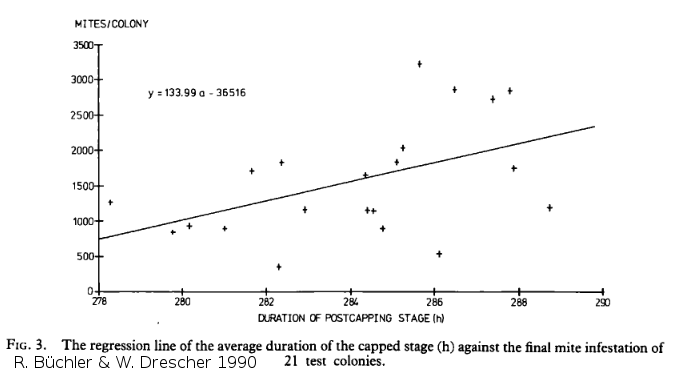
Sur le graphique déroulant de leur étude, on peut voir une corrélation entre infestation et durée d'operculation. Une heure de réduction de la durée d'operculation réduirait l'infestation finale de 8,7%.
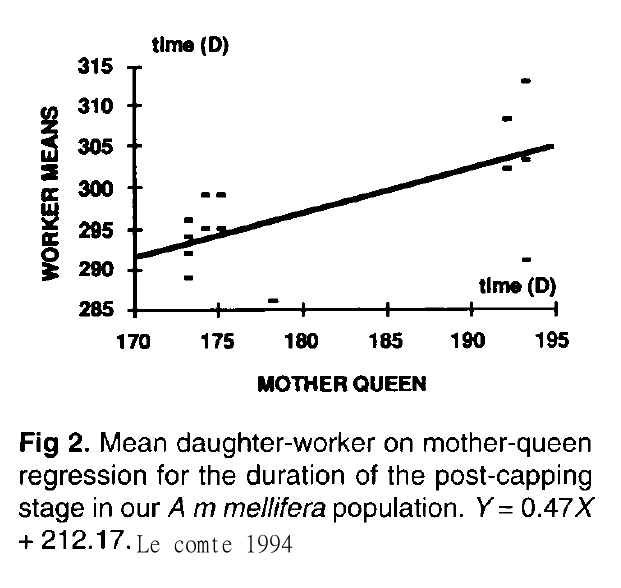
Suite à ces travaux, en 1994, Leconte a montré que la durée de développement de la reine était proportionnelle à celle des ouvrières qu’elles engendrent. Des travaux de sélection ont permis de baisser la durée de développement des ouvrières de 287.4 h à 276.4 h (Siuda and Wilde, 1998 ). Malheureusement cela n’a pas eu d’impact significatif sur la résistance des abeilles aux varroas.
3.3. Suppressed mites reproduction
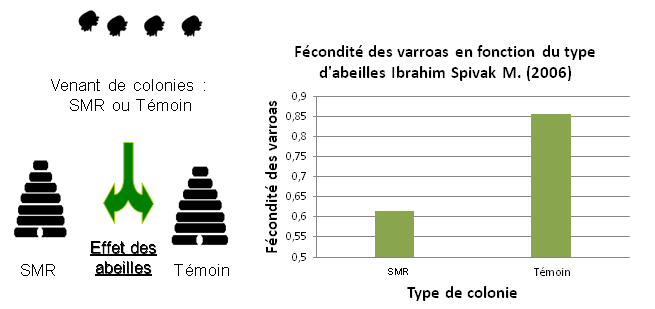
En 2006, Spivak a infesté des colonies avec des varroas. Les chercheurs ont ensuite étudié la proportion des fondatrices varroas arrivant à se reproduire. Ils ont observé que certaines abeilles que l’on appellera SMR (Suppressed mites reproduction), diminuent la proportion de varroas reproducteurs. Ce caractère semble avoir plusieurs composantes imbriquées les unes dans les autres.
3.3.1. Varroa sensitive hygiene (VSH)
L’hypothèse proposée par la suite, présentée sur le document ci-dessus, était que des abeilles avaient un comportement de nettoyage spécifique vers des cellules où les varroas ont réussi à se reproduire. Ce comportement particulier a été appelé VSH (Varroa sensitive hygiene).
3.3.2. L’effet du couvain
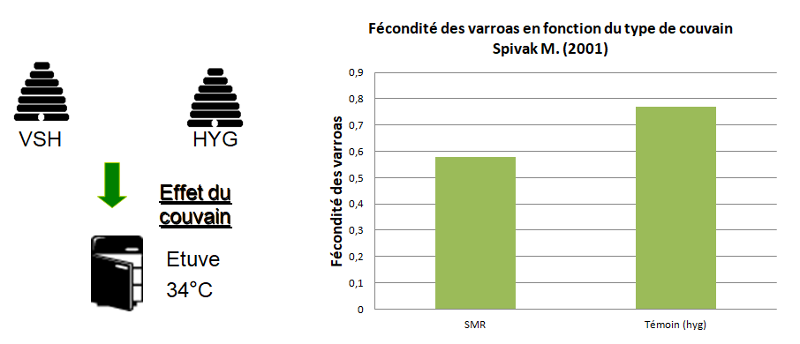
Dans le même article de 2006, du couvain provenant de différentes types d’abeilles a été mis à l’étuve jusqu’aux stades tardifs. On observe que même s'il n'est pas au contact d’abeilles adultes, le taux de varroas reproducteurs est plus faible. Il existe plusieurs hypothèses. La première est qu’il existe un effet couvain. En effet, certains couvains pourraient produire ou non certaines phéromones, ce qui perturberait la reproduction des varroas. La deuxième hypothèse est celle de la désoperculation.
3.3.3. Recapping: réoperculation
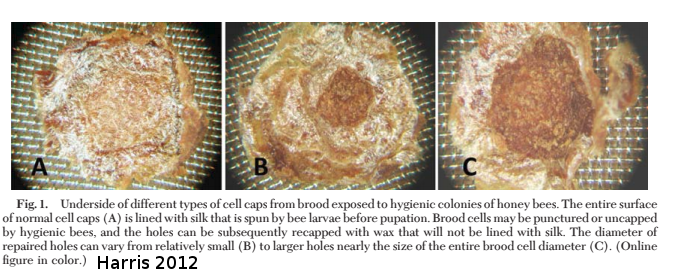
Harris a montré en 2012 que les abeilles sont capables d’ouvrir puis de refermer les opercules. On parle de recapping. On peut identifier ces alvéoles car sous l’opercule, on peut voir que le couvain n’est pas continu. Sur les photo ci-dessus, on peut voir à droite le dessous d’une cellule normale. A gauche on observe qu’une partie du cocon est absent. A droite on remarque que la majorité du cocon est absent.
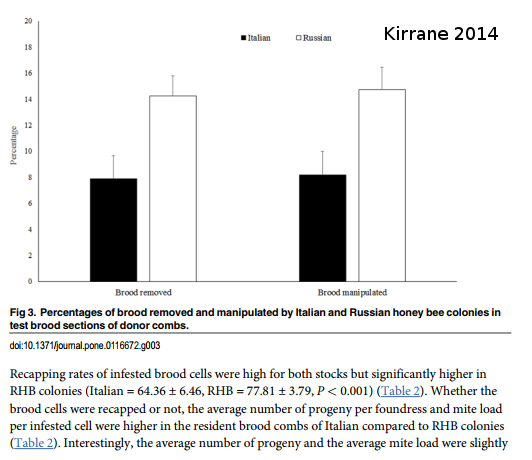
En 2017, Kirrane étudie une population d’abeilles russes résistantes aux varroas. On peut voir que ces abeilles ont un niveau de ré-operculation plus fort que les abeilles italiennes (témoin).
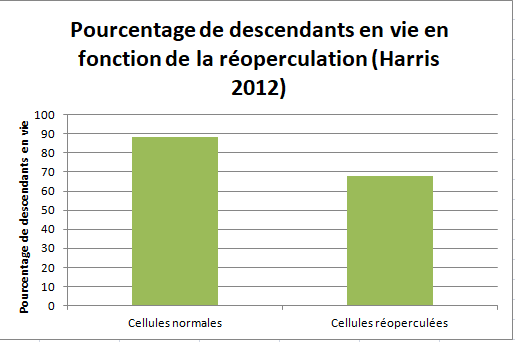
Le graphique suivant (Harris 2012) présente le pourcentage de descendants varroas vivants. On peut voir que la réoperculation a un impact sur leur taux de survie. L’hypothèse va même plus loin en proposant que les modifications des conditions de température dans la cellule lors de l’ouverture pourraient conduire à une baisse de la fertilité des mâles. Ce phénomène pourrait expliquer l’effet couvain décrit par Spivak. En effet, ces mâles stériles féconderaient mal leurs soeurs. Ces nouvelles fondatrices seraient alors des fondatrices non reproductrices.
3.4. Sélection sur des marqueurs protéiques
Here we demonstrate the utility of protein markers to select for disease-resistant hygienic behavior in the European honey bee (Apis mellifera L.). Robust, mechanistically-linked protein expression markers, by integrating cis- and trans- effects from many genomic loci, may overcome limitations of genomic markers to allow for selection. After three generations of selection, the resulting marker-selected stock outperformed an unselected benchmark stock in terms of hygienic behavior, and had improved survival when challenged with a bacterial disease or a parasitic mite, similar to bees selected using a phenotype–based assessment for this trait. This is the first demonstration of the efficacy of protein markers for industrial selective breeding in any agricultural species, plant or animal.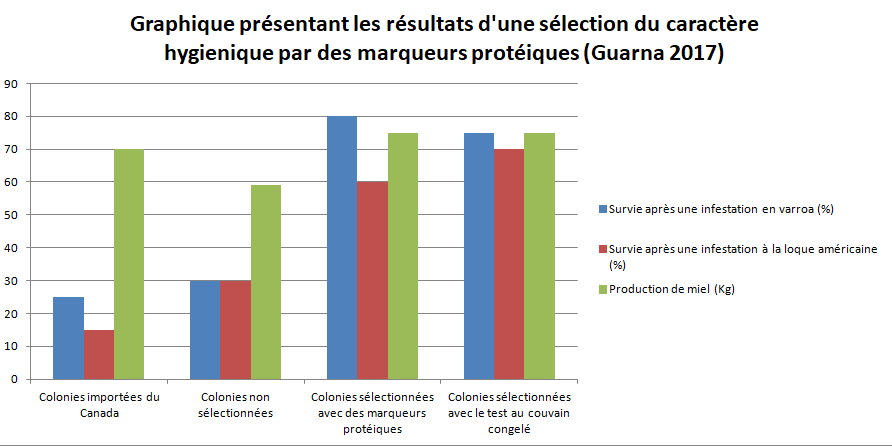
Historiquement les marqueurs génétiques sont préférés aux marqueurs protéiques qui sont plus sensibles à l'environnement. Le fort taux de recombinaison de l'abeille fait que les marqueurs génétiques peuvent rapidement ne plus être en corrélation avec les gènes codant un caractère. L'avantage des marqueurs protéiques est d'être directement impliqués dans le caractère. Pour cela en 2017, Guarna a effectuée une sélection basée sur des marqueurs protéiques (BM-40-SPARC, VAMP). Ces protéines était des protéines liées au caractère hygiénique (au sens large). Le graphique ci dessus nous montre que les marqueurs moléculaires ont permis d'augmenter la résistance au varroa et à la loque aussi bien qu'une sélection directement sur le test au couvain congelé.
Conclusion:
La morphologie du varroa et son comportement reproducteur sont le résultat de la course à l'armement avec cerana. Cerana s'est adaptée au varroa. Nous avons vu que le varroa a lui aussi développé des stratégies de défense. Le changement d'hôte sur une espèce n'étant pas adaptée a été une vraie réussite pour le varroa. Il se multiplie environ 12 fois en 1 an dans les régions froides (128 jours de couvain) et 800 fois où il y a toujours du couvain. Afin de protéger nos abeilles non adaptées, nous devons trouver des stratégies. Les traitements bio sont une alternative à court terme. Seule la multiplication des rares colonies résistantes est une solution durable.
Pour aller plus loin:
Pourquoi les abeilles vivent en colonies?
Comment analyser le pollen de mon miel?
Comment estimer le nombre d'abeilles sur un cadre?
Connaitre le vocabulaire d'apiculture
Quels sont les meilleurs livres d'apiculture?
Corona virus , quels risques de faire de l'apiculture?