Analyse pollinique du miel : Melissopalynalogie
Cet article vous présente comment analyser le pollen de votre miel (Melissopalynalogie) pour en déterminer l'origine. Vous trouverez aussi comment préparer et observer au microscope du pollen frais.
Les audits Protéis en 2012 et GEM en 2004 nous indiquent que la production de miel Français a diminué de 28% entre 2004 et 2010 alors que les importations ont augmenté de 49%. Le prix ces miels est nettement plus bas que ceux des miels Français (main d’oeuvre, système de production...). Il devient intéressant de savoir discriminer un miel local d'un miel étranger. On retrouve du pollen dans miel. Nous pouvons donc nous demander comment identifier l’origine d’un miel à partir du pollen.
Dans un premier temps nous verrons en quoi le pollen est un bon indice de l’origine d’un miel. Dans une seconde partie, nous présenterons les méthodes pour déterminer l’origine d’un miel.
Sommaire:
1. Intérêt du pollen pour reconnaître un miel
1.1. Origine du pollen
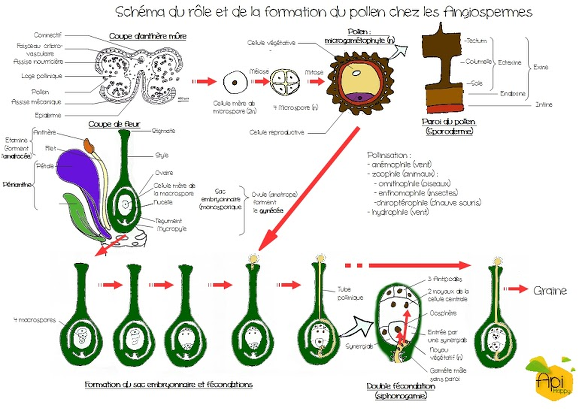
Le schéma plus bas présente la formation du pollen et son rôle dans le cycle de reproduction des plantes à fleurs. Les anthères dans les étamines des fleurs sont le lieu de production du pollen. Les microspores haploïdes sont à l'origine du grain de pollen. Ils se divisent en deux cellules par mitose: la cellule végétative et la cellule reproductrice. La cellule végétative formera le tube pollinique. La croissance est orientée dans le pistil par un gradient de calcium. La cellule reproductrice du pollen donne deux gamètes après une division (mitose). On peut donc parler de gamétophyte pour le pollen.
Lors de la pollinisation, les grains sont transportés jusqu’aux stigmates. La pollinisation peut être effectuée par des facteurs abiotiques comme le vent. On parle d’anémophilie. Les animaux peuvent aussi intervenir. On parle alors de zoophilie.
Avant la fécondation, dans l’androcée de la fleur recevant le pollen, un sac embryonnaire s’est formé. On y retrouve 3 antiopodes, 2 synergides, une oosphère et une cellule centrale à deux noyaux. La fécondation double par siphonogamie se déroulera lors de l’entrée du tube pollinique dans une synergide. Il libérera les deux gamètes qui fusionneront avec la cellule centrale pour donner l’albumen servant de réserve à la germination ou avec l’oosphère pour former le zygote. Une graine va ensuite se développer.
Le pollen est donc au centre du cycle de reproduction des plantes à fleurs (Angiosperme). Cet élément mobile contribue indirectement à la reproduction sexuée des plantes. Il permet donc le brassage des génomes au sein des populations.
Ce brassage permet une fixation plus rapide des caractères de résistance aux parasites dans une population.
1.2. Observer du pollen provenant de fleurs
Afin de se faire une propre base de données ou d’identifier les pelotes de pollen apportées par les ouvrières, il peut être nécessaire de savoir étudier le pollen frais.
Matériel:
-Lame, lamelle
-Alcool à 90°
-Si vous voulez conserver les lames, utilisez de la gélatine glycérinée (GG) colorée avec de la fuchsine de Ziehl. Il existe des préparations toutes faites : “fuchsine " : la Glycérine Jelly (Brunel). Pour une observation sans conservation, utilisez simplement une solution de fuchsine. Il est possible d’observer le pollen sans coloration, mais toutes ses caractéristiques ne sont pas toujours visibles.
- Du pollen prélevé à la pincette sur les fleurs (juste ouvertes ou pas encore).
- Pincettes, bistouri...
- Lame micromètre si vous souhaitez mesurer la taille des grains. Si vous utilisez une caméra, prendre des photos de la lame micromètre comme image étalon.
Pour une mesure sans capture d’image, utiliser un oculaire gradué. Dans un premier temps, faire la correspondance entre les graduations de l'oculaire et celles de la lame micromètre pour chaque objectif. Ensuite, il vous suffit de mesurer vos objets avec l'oculaire et de convertir en taille réelle.
Protocole:
1. Prélever les anthères et les déposer sur la lame dans une goutte d'alcool. Pour les fleurs où les anthères sont petites, il est plus simple de dilacérer les fleurs. Pour les pelotes de pollen, il vous suffit de mettre sur une lame un petit fragment.
2. Mélanger le pollen à l’alcool afin d’enlever les graisses et la résine recouvrant le pollen. Si ces dernières forment une auréole blanchâtre sur la préparation, l'essuyer délicatement avec du papier Joseph.
3. Sécher la lame à 35°C pour fixer les pollens en la positionnant au-dessus d’un réchaud à une hauteur où l’on ne se brûle pas la main. Il ne doit plus rester d’alcool.
4. Faire couler de l’alcool en gouttes à gouttes sur la lame inclinée pour laver la lame. Les restes de fleurs et les lipides seront emportés par l’alcool.
5. Faire 4 cycles lavage-séchage à l’alcool. Pour les préparations difficiles à dégraisser, réaliser l’avant dernier un lavage avec de l’eau savonneuse.
6. Recouvrir la préparation de fuchsine de Ziehl.
7. Faire un nouveau cycle de lavage à l’alcool-séchage.
8. Mettre une goutte d’eau puis une lamelle.
9. Observer au microscope avec un grossissement de 400. Pour cela, commencer par chercher un élément à l’objectif 4 puis 10 pour finir avec l’objectif 40.
10. Si vous avez un dispositif de prise d’image, utilisez Microcartouche pour légender vos images.
Vous trouver ci-dessous la vidéo du protocole de coloration à la fuschine et d'observation du pollen frais.
1.3. Interaction pollen-miel
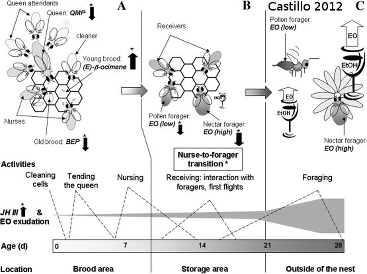
Le document ci-dessus présente les différentes hormones marquant la répartition du travail chez les abeilles (polyéthisme):
- la BEP (Brood Ester Hormone) produite par le couvain
- la QMP (Queen mandibular pheromone) produite par la reine
- la E-β- ocimen produite par le couvain jeune
- l'éthyl oleate (EO) produite par les butineuses.
L'EO est le résultat de la transformation de l'alcool du nectar par les abeilles en exudat présent sur la cuticule. Le rapport entre les abeilles ramenant du pollen ou du nectar est codé dans la ruche par la quantité de EO.
Les butineuses ramenant du pollen sont des abeilles de plus de 21 jours. Le passage en butineuse est dû à une augmentation d'hormone juvénile (JH).
Pour prélever le pollen des fleurs, les abeilles concentrent le pollen en pelote sur leur 3ème paire de pattes à l'aide des leurs premières paires de pattes. Les photos nous montrent que de grandes soies forment une corbeille à pollen. Elles utilisent aussi une structure en peigne et en brosse pour déplacer le pollen.
Les butineuses s'occupant du nectar prélèvent toujours du pollen en même temps que le nectar. Il y aura des contaminations secondaires. Dans la ruche, le pollen est reçu par des ouvrières qui vont le stocker. Il sera stocké dans des cellules bâties entre le miel et le couvain.
Durant toutes ces étapes, une partie du pollen se trouvera mélangé en petite quantité avec les miels avant son operculation. L'étude du pollen de miel permet de retracer les fleurs présentes durant le stockage du miel. Le pollen est donc un indicateur des fleurs butinées par les abeilles à un moment donné.
2. La méthode qualitative:
Il est possible de connaître l'origine d'un miel à partir de l'étude des plantes à l'origine du pollen.
2.1. Préparation du miel
Matériel:
- 1 bécher de 50 mL
- eau distillée
- centrifugeuse et tubes pour centrifugeuse
- pipettes pasteur ou cônes de micro pipette
- agitateur magnétique
- lame
- lamelle
- feutre à alcool
- fuschine
- réchaud
- spatule
- microscope
- glycérine (si l’on veut conserver les lames)
Temps:
15 minutes
Pendant toute la manipulation, un grand soin doit être pris pour éviter toute contamination de pollen étranger, provenant soit des préparations de miel précédentes (des fournitures jetables sont recommandées dans la mesure du possible) ou à partir de grains de pollen dans l'air (fermer les fenêtres).
Protocole:
1. Peser 10g de miel à 0,1g près dans un bécher (de capacité 50mL). Ajouter 20-30mL d’eau distillée (20°C-40°C) et dissoudre le miel. Si vous avez des tubes à centrifuger de 50mL, utillisez ces tubes, sinon séparez la solution dans plusieurs tubes.
2. Centrifuger cette solution pendant 10min à 1000g. Pipetter le surnageant. Regrouper les culots dans un tube et ajouter 20 mL d’eau distillée pour dissoudre complètement les cristaux de sucre restant. Utiliser une micro-spatule ou une pipette Pasteur pour aller jusqu’au fond du tube à centrifugation. (Préférez les pipettes Pasteur jetables de 1mL pour éviter les contaminations avec d’autres échantillons).
3. Centrifuger pendant 5min à 1000g. Pipeter tout le surnageant. Pour la dernière goutte, placer le tube à l’envers à 45° pour permettre au liquide en excès d’être absorbé par du papier absorbant.
3 bis. Si vous souhaitez garder les lames, vous devez faire ces étapes durant la centrifugation. Porter une plaque chauffante à 40°C pour liquéfier la glycérine (milieu de montage; Kaiser’s Glycerol GelatineTM Merck 1.09242.0100) en la chauffant à moins de 40°C (soit avec une plaque chauffante soit avec un bain marie).
La glycérine peut être utilisée telle quelle ou être colorée en ajoutant quelques gouttes de solution de fuschine basique et éthanol (0,1% w/v) : 0,5 à 1mL de cette solution et 10mL de glycérine.
Utiliser un marqueur indélébile pour réaliser un carré de 22x22mm sur une lame. Placer la lame sur la plaque chauffante (si la lame doit être conservée longtemps, réaliser le carré sur le dos de la lame ou directement sur la plaque chauffante pour éviter que le marquage s’efface et pour éviter une coloration involontaire des grains de pollen).
Si vous ne souhaitez pas conserver vos lames, réalisez une préparation avec de la fuschine et de l’eau.
4. Mélanger complètement le culot à l’aide d’une pipette Pasteur et le transférer avec cette pipette sur la lame. Une petite perte de pollen à ce stade est acceptable puisque la méthode est qualitative.
5. Etaler le culot à l’aide d’une micro-spatule sur la surface marquée de 22x22mm.
Pour un miel très riche ou très pauvre en pollen, la surface peut être trop petite ou trop grande pour permettre une observation facile. Dans de tels cas, il est possible d’étaler le culot sur une surface plus appropriée en dessinant un carré de taille adaptée.
6. Sécher le dépôt à moins de 40°C pour ne pas faire brunir les sucres restants. Réchauffer quelques lamelles (22 × 22 mm ou d'une autre taille selon les cas) sur la plaque chauffante. Prendre une goutte de glycérine, l'appliquer sur la lamelle pour former une grande croix en diagonale. Ce faisant, les grains de pollen resteront dans leur position de séchage lorsque l’on abaissera la lamelle sur le culot séché.
7. Déposer la lamelle sur la lame très lentement pour éviter les bulles d'air. Laisser la préparation sur la plaque de chauffage pendant 5 min pour une répartition uniforme de la glycérine et un gonflement égal des grains de pollen. Ne jamais appliquer la goutte de glycérine directement sur le culot séché.
8. Observer la lame au microscope.
Il faut compter au moins 300 grains de pollen pour avoir une estimation de la fréquence relative des types de pollens, et de 500 à 1000 grains de pollen pour la détermination des fréquences relatives (Behm et al., 1996).
L'examen au microscope est réalisé au grossissement le plus approprié pour identifier les différents éléments dans l’échantillon (de x400 à x1000). Après une première vérification générale pour déterminer les principaux types de grains de pollen et leur abondance, les fréquences relatives de chaque type de pollen sont déterminées comme suit :
- Identifier et compter les grains de pollen par groupes de 100, en suivant des lignes parallèles équidistantes de manière uniforme, distribuées d’un bord de la lamelle jusqu’au bord opposé, jusqu'à avoir compté 500 grains. Si les fréquences relatives ne sont pas stabilisées ou si le nombre de 500 grains n'est pas suffisant pour l'interprétation (spectre complexe, pollen sur-représenté, pollen abondant de plantes sans nectar ou d’autres conditions qui peuvent masquer la source réelle du nectar du miel), poursuivre le comptage jusqu’à 1000 en suivant 5 autres lignes parallèles entre les premières.
Pour analyser la lame, la matrice présente en Figure 1 doit être utilisée pour garantir une homogénéité de l’examen. Chaque champ de vision (compter les arrêts) doit être réparti uniformément le long de la ligne, et la distance entre chaque arrêt doit être calculée en fonction de la densité des grains de pollen dans la préparation, et de la taille du champ de vision. Dans le cas d'un miel de très faible teneur en pollen, il peut être nécessaire de compter la ligne complète d’un seul coup.
- Compter les grains de pollen avortés, irréguliers ou cassés s'ils peuvent être identifiés. Noter séparément les grains non identifiables ou non identifiés.
- Noter également séparément les éléments de miellat (HDE), c’est-à-dire les spores fongiques, les hyphes et des algues microscopiques.
- Noter les autres constituants du culot comme la matière cristalline finement granuleuse (Demianowicz, 1963), les levures, les impuretés, la suie, les globules gras, l'amidon, les particules végétales.
- Si le sédiment contient un pourcentage élevé de pollens sur-représentés (comme Myosotis, Castanea ou Eucalyptus), il est recommandé d'effectuer un second comptage en excluant le pollen sur-représenté pour déterminer plus précisément l’abondance relative des autres types de pollens.
Cette procédure nécessite une durée variable en fonction de la complexité du spectre pollinique et de l'expérience de l'analyste (généralement 30 min à 1 h).
2.3 Calcul et présentation des résultats
Pour chaque type de pollen, calculer la fréquence relative comme les pourcentages respectifs en fonction du nombre total de grains comptés. Seuls les comptages d’au moins 500 grains devraient être exprimés en pourcentages (Behm et al.,1996).
Pour la détermination de l'origine botanique du miel, recalculer la fréquence relative en excluant les pollens des plantes sans nectar. Si un ou plusieurs types de pollen sont surreprésentés ou si d’autres évaluations indiquent que le nectar correspondant n'est pas important (analyse pollinique quantitative, sensoriel, etc), recalculer la fréquence relative en excluant également ces types de pollen.
Les types de pollen doivent être nommés par leurs noms de genre ou d’espèce botanique uniquement lorsqu'ils ont été déterminés de manière fiable au niveau du genre ou de l'espèce, respectivement, ce qui se produit rarement. Dans le cas contraire, une note devrait être ajoutée après le nom scientifique, comme le groupe, la forme ou le type, pour indiquer que le terme est utilisé dans un sens plus large.
2.4 Interprétation des résultats
La reconnaissance des pollens demande de l'entrainement. Il existe de nombreuses clés sur internet.
2.4.1 Origine botanique
La détermination de l'origine d'un miel est basé sur l'abondance du pollen d'une espèce. Cette dernière est très variable suivant l'origine du nectar.
En général, un miel est considéré comme unifloral si le pollen d'un fleur représente plus de 45% du pollen. On parle de miellat si il y a plus de 3 fois plus d'éléments marqueurs de miellat (HDE) que de fleur (PG).
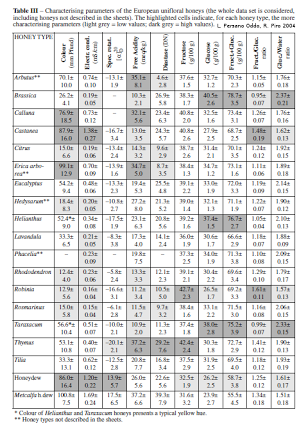
Le tableau suivant nous montre que les abondances des pollens dans les miels unifloraux sont très variables.
Tableau de l'abondance globale et spécifique en pollens de miels unifloraux (W; Von der Ohe et al 2004)
| Sous représentés en pollen | Potentielement sous représentés | Normalement représentés en pollen | Sur représentés en pollen |
| Arbutus (8-20%) | Calluna (10-77%) | Erica (>45%) | Castaena (>86%) |
| carduus (5-25%) | Helianthus (12-92%) | Eryobotrya (>45%) | Eucalyptus (>83%) |
| Citrus (2-42%) | Rhododendron (15-77%) | Hedysarum (>50%) | Brassica napus (>60%) |
| Lavandula latifolia (15-42%) | Robinia (7-60%) | Phacelia (>60%) | |
| Lavandula x intermedia (1-20%) | Rosmarinus (10-57%) | ||
| Medicago (1-10%) | Thymus (13-68%) | ||
| Taraxacum (5-40%) | Tilia (1-56%) |
Il est donc nécessaire de coupler l'analyse pollinique d'un miel avec des études sensorielles et physico-chimiques.
2.4.2 L'origine géographique d'un miel
Pour déterminer l'origine géographique d'un miel, il est nécessaire de comparer le spectre pollinique de miel avec le spectre floral de la région.
3. La méthode quantitative:
Au cours de la saison, l'abondance de pollen varie. De plus, toutes les fleurs ne produisent pas autant de pollen. Il est donc possible de déterminer l'origine d'un miel à partir de la quantité de pollen.
3.1. Préparation du miel
Matériel:
- filtre avec une membrane de cellulose ayant des pores de 3 µm et un diamètre de 25 à 47mm. (chez millipore: SSWP02500 ou SSWP 04700)
- eau distillée
- microscope
- lame étalon
- alcool
- fuschine
- microscope avec de l'huile à immersion.
- lame/ lamelle
Protocole:
1. Peser 10g de miel à 0,1g près dans un bécher (de capacité 50mL). Ajouter 30-40 mL d’eau distillée (20°C-40°C) et dissoudre le miel. La dilution est plus forte que pour la méthode qualitative, pour faciliter la filtration et améliorer la distribution des grains.
2. Afin de faciliter la reconnaissance des pollens, vous pouvez utiliser 0.1% d’une solution d’alcool et de fuschsine.
3. Filtrer avec une membrane de cellulose avec des pores de 3 µm et un diamètre de 25 à 47mm. (chez millipore: SSWP02500 ou SSWP 04700)
4. Rincer le bécher plusieurs fois avec un peu d’eau et filtrer la solution.
5. Sécher le filtre à 40°C.
6. Monter le filtre entre lame et lamelle dans de l’huile à immersion. Pour les filtres de 47mm, il faut les couper en deux et les observer séparément.
3.2. Dénombrement des pollens
Utiliser un microscope optique et choisir un objectif permettant de voir entre 10 et 20 éléments par champ. Il est nécessaire décompter au moins 500 éléments dans au moins 100 champs.
Observer en balayant le filtre. Lorsque vous choisissez un nouveau champ, il ne faut pas regarder dans le microscope pour ne pas être influencé. Parcourir la lame en 10 parallèles équidistantes.
3.3 Interprétation des résultats
Pour calculer le nombre d'éléments (N), il est nécessaire de connaitre la surface du filtre contenant des particules (S) et l'aire du champ du microscope au grossissement utilisé. Pour cela, vous pouvez utiliser un lame étalon micromètre.
Le nombre absolu de pollens dans 10 g de miel (PG/10g) et le nombre d'éléments marqueurs de miellat (HDE/10g) sont calculés d'après les formules suivantes:
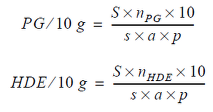
Légendes:
S: Surface de filtre contenant des particules (mm²)
s: Surface d'un champ de microscope (mm²)
nPG: Nombre de grain de pollen comptés
nHDE: Nombre d'éléments marqueurs de miellat
a: Nombre de champs comptés
p: Poids de miel utilisé (g)
La somme des deux résultats (exprimé en 103) est égale à N. Il permet de classer les miels en 5 catégories:
I: N ≤ 20 x 103 : miels unifloraux sous représentés en pollen
II: 21 x 103 ≤ N ≤ 100 x 103 : Majorité des miels multifloraux, des miellats et mélange miellat-miel de fleurs
III: 101 x 103 ≤ N ≤ 500 x 103: Miels unifloraux sur représentés en pollen et miellat.
IV: 501 x 103 ≤ N ≤ 106: Miels unifloraux très sur représentés en pollen et miels extraits par pressage.
V: N > : Miels extraits par pressage.
Conclusion:
En conclusion, nous pouvons voir que l'analyse des pollens d'un miel donne des indices sur l'origine d'un miel. Il reste cependant nécessaire d'utiliser d'autres indices pour donner une interprétation sûre de l'origine d'un miel. Le document suivant nous indique les caractéristiques physico-chimiques des différents miels unifloraux.
Pour aller plus loin:
Pourquoi les abeilles vivent en colonies?
Comment estimer le nombre d'abeilles sur un cadre?
Connaitre le vocabulaire d'apiculture
Quels sont les meilleurs livres d'apiculture?
Corona virus , quels risques de faire de l'apiculture?
Bibliographie:
BARTH, Ortrud Monika. (2004) - Melissopalynology in Brazil: a review of pollen analysis of honeys, propolis and pollen loads of bees.
Battesti, M.-J. (1990) -Contribution to Mediterranean melissopalynology: Corsican honeys.
Baudilio Herrero, Rosa María Valencia-Barrera, Roberto San Martín, and Valentín Pando (2002) -Characterization of honeys by melissopalynology and statistical analysis
Carlos Castillo, Alban Maisonnasse, Yves Le Conte, Erika Plettner (2012) - Seasonal variation in the titers and biosynthesis of the primer pheromone ethyl oleate in honey bees
Gretchen D. Jones & Vaughn M. Bryant Jr. (1992) - Melissopalynology in the United States: A review and critique
Livia PERSANO ODDO, Roberto PIRO (2004) - Main European unifloral honeys: descriptive sheets
Livia PERSANO ODDO, Stefan BOGDANOV (2004) -Determination of honey botanical origin: problems and issues
M.J Battesti , Y. Yin Yang , N. Djabou , A. Muselli , J.M. Desjobert , J. Paolini , J. Costa (2010) - Melissopalynological certification of geographical and botanical origins of the Protected Designation of Origin: "Miel de Corse - Mele di Corsica"
Ministère de l'agriculture (2013) - PLAN DE DÉVELOPPEMENT DURABLE DE L’apiculture
of analytical methods.
Werner VON DER OHE, Livia PERSANO ODDO, Maria Lucia PIANA, Monique MORLOT, Peter MARTIN (2004) - Harmonized methods of melissopalynology
Werner VON DER OHE, Livia PERSANO ODDO, Maria Lucia PIANA, Monique MORLOT, Peter MARTIN (2008) - Pollen composition and standardisation
Yin Yang, Marie-José Battesti, Nassim Djabou, Alain Muselli , Julien Paolini, Pierre Tomi, Jean Costa (2012) - Melissopalynological origin determination and volatile composition analysis of Corsican ‘‘chestnut grove’’ honeys







