Fécondation des reines: les congrégations de mâles chez l'abeille
Cet article a été écrit avec Florian Bastin, Thibault Chaumont et Jean-Christophe Sandoz de l’équipe EVOLBEE du laboratoire Évolution, Génomes, Comportement et Ecologie du CNRS de Gif-sur-Yvette.
Site web de l’équipe : http://www.egce.cnrs-gif.fr/?page_id=3786
L'abeille domestique Apis mellifera est devenue un animal modèle pour l'éthologie, la neurobiologie et la cognition animale du fait de son répertoire comportemental riche et de ses impressionnantes capacités cognitives (Von Frisch, 1965 ; Menzel, 1999; Menzel, 2012). Les abeilles sont parmi les insectes ayant la plus grande valeur économique puisque, en parallèle de leur utilisation en apiculture, elles sont les principales pollinisatrices impliquées dans la production de nombreux fruits, légumes et cultures céréalières. Elles jouent donc un rôle crucial dans la production mondiale de denrées alimentaires (United Nations Environmental Program, 2010). Pourtant, bien que de nombreux aspects de la biologie de cet organisme modèle soient élucidés, certains points cruciaux de son comportement reproductif, essentiels pour une optimisation des stratégies d’apiculture, restent inconnus. En effet, la maîtrise des phénomènes de congrégations permettrait la mise en place de congrégations « contrôlées ». On choisit ainsi la zone d’accouplement en fonction des critères de sélection et de conservation. Nous chercherons donc à comprendre la structure et la mise en place de ces congrégations.
Sommaire:
1. Les congrégations: une rencontre faux bourdons et reines
Les abeilles présentent un comportement d'accouplement particulièrement saisissant, qui a depuis longtemps fasciné aussi bien les apiculteurs que les chercheurs (Ruttner, 1957 ; Baer, 2005). Pendant la période de reproduction, les mâles matures volent au-dehors de la ruche durant les après-midi ensoleillés et se regroupent en congrégations compactes (diamètre entre 30 et 200 m), généralement à une altitude comprise entre 10 et 40 m au-dessus du sol (Loper et al., 1987 ; Loper et al., 1992 ; Koeniger and Koeniger, 2004) (Figure 1a). Une congrégation peut regrouper jusqu'à 11000 mâles issus de près de 240 colonies différentes (Free, 1987; Baudry et al., 1998 ; Koeniger et al., 2005). Pour observer les congrégations, il faut une après-midi ensoleillée, chaude et sans vent (Winston 1987) (Figure 1c). Les mâles évoluent au sein de cette congrégation, dessinant de larges boucles dans le ciel et ne retournent à la colonie que pour se nourrir. Ensuite seulement, les reines vierges viennent retrouver les mâles dans ces congrégations.
1.1. Les congrégations: un lieu d'accouplement avec des reines
Quand une reine vierge entre dans la congrégation, elle attire à elle de nombreux mâles, dans un premier temps par des signaux olfactifs (phéromone de reine vierge) et à plus courte distance par des indices visuels (Gries et Koeniger, 1996). Les mâles suivent les reines vierges en formant un essaim en forme de comète, et luttent pour s'accoupler avec la reine (Gries et Koeniger, 1996) (Figure 1b). La reine s'accouple avec 10 à 20 mâles sur une période allant de 15 à 30 minutes (Free, 1987). Ces mâles meurent directement après l'accouplement (Baudry et al., 1998; Palmer and Oldroyd, 2000).
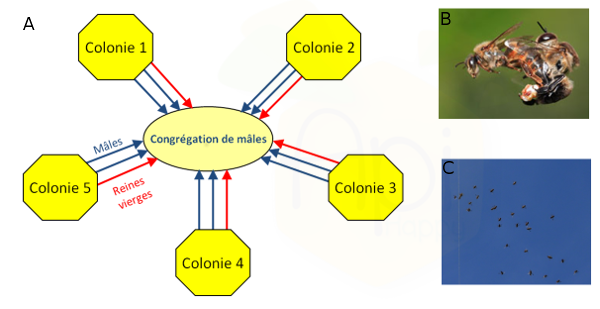
Figure 1 : Reproduction chez Apis mellifera. 1a) Schéma descriptif de la formation des congrégations : les mâles matures volent au-dehors de leurs colonies et se regroupent en congrégations compactes. Ensuite, les reines rejoignent les congrégations pour s’accoupler avec une douzaine de mâles en moyenne (Bastin Florian, en préparation). 1b) Copulation entre une reine et un mâle d’Apis mellifera (http://www.waldeneffect.org). 1c) Photo d’une congrégation (équipe EVOLBEE).
1.2. Les mâles: des individus spécialisés pour la reproduction
1.2.1. Le rôle des mâles dans la colonie
Les études sur les mâles chez les abeilles sont beaucoup moins nombreuses que celles réalisées sur les ouvrières. En effet, les mâles sont moins présents dans une ruche (100 mâles contre des dizaines de milliers d’ouvrières) et à des périodes de l’année courtes et précises (été). Cependant, quelques études se sont intéressées aux mâles et à leur rôle dans la ruche. À ce jour, le seul rôle connu du mâle abeille est la reproduction. Les mâles ne récoltent pas de nourriture et consomment au contraire les stocks de la ruche. Les mâles sont issus d’un gamète femelle non fécondé. Ils sont pondus généralement à la fin du printemps et en été, dans des cellules plus grandes que celles des ouvrières (exemple d’un cadre de mâle (Figure 2)). Ils peuvent être issus de la reine ou des ouvrières lorsqu’il y a absence de cette première. Le cycle de développement du mâle est plus long que celui des femelles et dure 24 jours (Figure2). Durant leurs premiers jours, les mâles ont tendance à se retrouver sur les mêmes cadres, sur les rayons contenant du couvain, là où la température est la plus chaude et où les nourrices sont disponibles pour les nourrir (Ohtani, 1974 ; Winston 1987) .Une fois sexuellement matures (l’âge de maturité des mâle fait encore débat au sein de la communauté scientifique, les inséminateurs préconisent 20-21 jours), , les mâles sortent des ruches et rejoignent les congrégations pour se reproduire. À la fin de l’été ou lors de plusieurs journées de pluie d’affilée, les ouvrières chassent les mâles des ruches et ceux-ci meurent alors de froid ou de faim, ne pouvant se nourrir seuls (Morse et al. 1967 ; Free et Williams 1975).

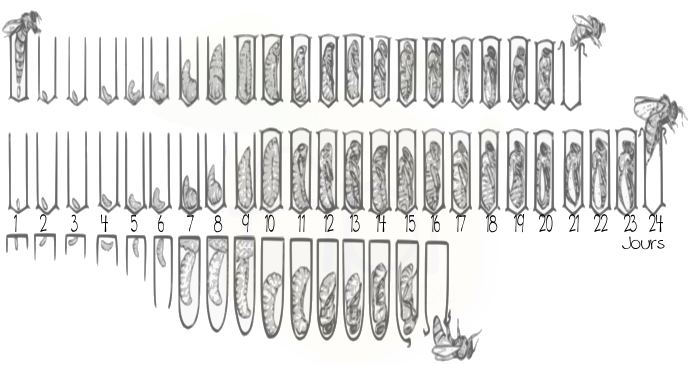
Figure 2: Cellules de mâles et cycle de développement du mâle abeille. Les mâles abeilles sont pondus généralement dans des cellules plus grosses que celles des ouvrières (photo : Alex Wild). Le cycle de développement du mâle est plus long que celui des autres castes femelles : 16 jours pour les reines, 21 pour les ouvrières et 24 pour les mâles.
1.2.2. Une anatomie spécialisée dans la détection des reines
Les mâles Apis mellifera sont ultra spécialisés pour la reproduction : par exemple, le mâle possède des muscles allaires beaucoup plus développés que les femelles (Winston 1987). Ces muscles vont lui permettre d’effectuer des vols nuptiaux à de longues distances et sur des durées plus importantes. Ils vont aussi faciliter la copulation en permettant un vol plus rapide pour rattraper la reine. Leurs yeux sont aussi beaucoup plus gros que ceux des femelles, portant ainsi de plus nombreuses ommatidies, leur permettant de mieux repérer les reines dans les congrégations (Sandoz, 2007 ; 10000 ommatidies pour seulement 5500 chez l’ouvrière, Streinzer et al., 2013) (Figure3).De plus, les antennes des mâles couvrent une surface 2 fois plus grande et possèdent 7 fois plus de sensilles olfactives que celles des ouvrières (Esslen et Kaissling, 1976) (Figure 4).
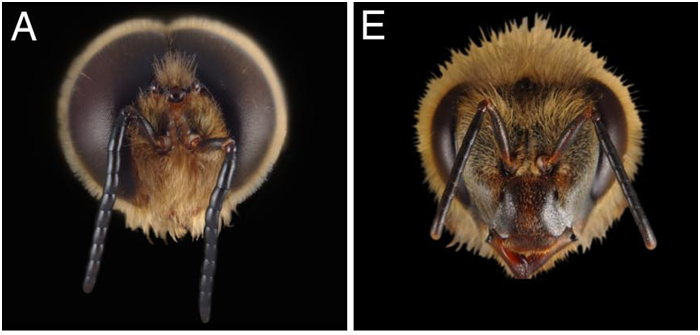
Figure 3 : Différences anatomiques de la tête des castes d’abeilles. Les yeux des mâles d’abeilles (A) sont beaucoup plus développés que ceux des ouvrières (E), (tiré de Wanner et al., 2007).
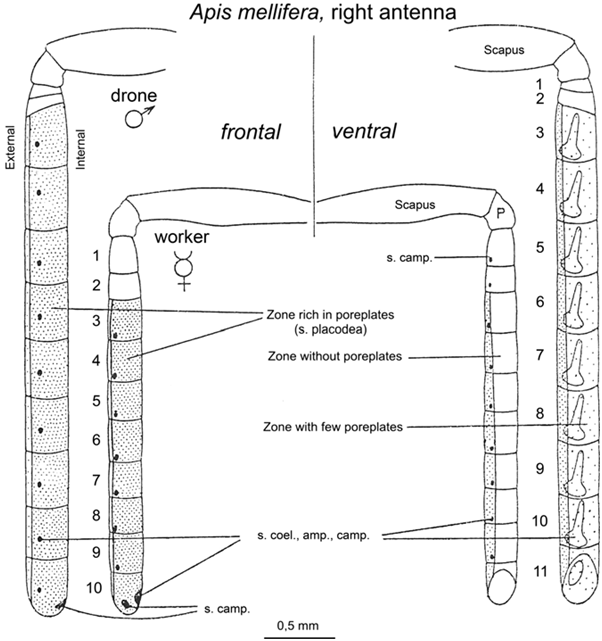
Figure 4 : Schéma des antennes de mâles et d’ouvrières d’abeilles. Les antennes de mâles couvrent une surface 2 fois plus grande et possèdent un article supplémentaire par rapport à celles des ouvrières (tiré d’Esslen et Kaissling, 1976).
Les mâles possèdent un système olfactif adapté spécifiquement à la détection des phéromones de reine. La phéromone mandibulaire de reine (QMP) renforce la cohésion sociale de la ruche en attirant les jeunes ouvrières, en les incitant à lécher les antennes de la reine, et en inhibant leur développement ovarien (Hoover et al., 2003 ; Slessor et al., 2005). Mais cette phéromone joue aussi un rôle central dans la reproduction, car elle est attractive pour les mâles d’Apis mellifera (Gary, 1962 ; Loper et al., 1993). La QMP est un mélange de 5 molécules qui varient en quantité au cours de la vie de la reine. Originellement, l'odeur de reine vierge est fortement dominée par le 9-ODA (9-Oxodec-2-enoic acid). Le ratio des composants de la QMP change après l'accouplement, conduisant à un mélange plus équilibré avec une proportion de 9-ODA moins importante chez les reines matures (Pankiw et al., 1996; Plettner et al., 1997). Il a été montré que le 9-ODA pouvait attirer les mâles vers les reines vierges depuis une distance d'au moins 60 m (Gary, 1962; Pain and Ruttner, 1963;Butler and Fairey, 1964). Cependant, le 9-ODA a un effet plus faible qu'un extrait complet de QMP (Pain and Ruttner, 1963). De plus, Pain et Ruttner en 1963 observent que les reines vierges attirent plus rapidement et en plus grand nombre les mâles d’abeilles que les reines fécondées. La phéromone de reine serait donc un mélange complexe plus efficace lorsque tous ses composants sont présents dans les bonnes proportions, c'est-à-dire celles retrouvées dans la QMP de reine vierge. Des données récentes suggèrent que l’acide 9-hydroxy-(E)-2-décénoïque et l'acide 9-hydroxy-(E)-2-décénoïque ((9-HDA) ) augmentent le nombre de contacts réalisés par les mâles sur un leurre de reine quand ils sont mélangés avec le 9-ODA (Brockmann et al., 2006).
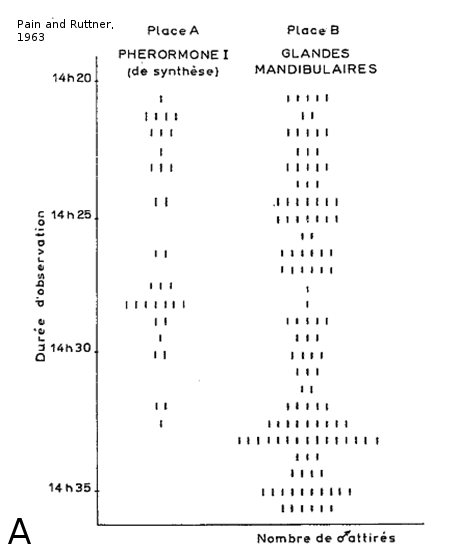
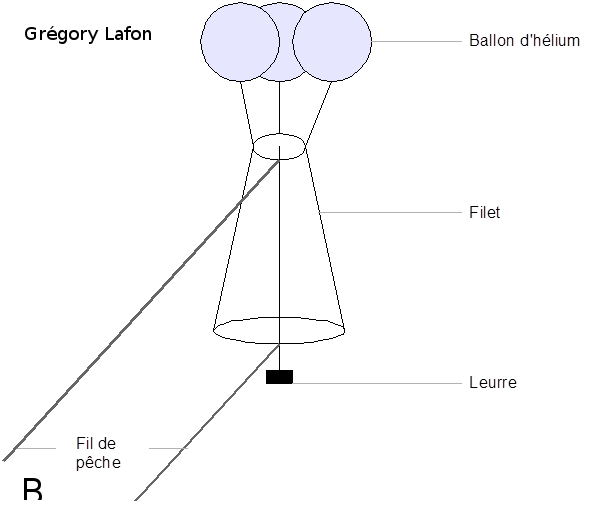
Figure 5 : Expérience d’attraction des glandes mandibulaires de reines sur les mâles en congrégation. L’expérience se déroule directement dans les congrégations. À l’aide de ballons d’hélium, un leurre imbibé d’une odeur est envoyé entre 6 et 15 m de haut dans la congrégation (5b). Dans l’expérience de Pain et Ruttner en 1963, deux leurres sont mis en compétition, l’un avec une phéromone de synthèse (9-ODA) et l’autre avec un extrait de glandes mandibulaires de reines (5a), et les expérimentateurs comptent le nombre de mâles attirés. On observe que les deux leurres sont attractifs pour les mâles mais que celui avec un extrait de glandes mandibulaires de reines est beaucoup plus attractif. Le 9-ODA est la molécule principale de la glande mandibulaire de reine vierge et il attire les mâles, mais son pouvoir attractif est décuplé avec la présence en bonnes proportions de toutes les autres molécules de la QMP (5a) figure tirée de Pain and Ruttner, 1963 ; (5b) schéma réalisé par Grégory Lafon).
La sensibilité des antennes de mâles est également plus importante pour la détection de la phéromone de reine. En effet, des expériences d’électroantennographie sur les antennes d’abeilles montrent que les mâles sont significativement plus sensibles que les ouvrières à la phéromone mandibulaire de reine, en particulier au 9-ODA (Skirkevieiene and Skirkevieius, 1994 (Figure 6) ; Brockmann and Brückner, 1998 (Figure 7)).
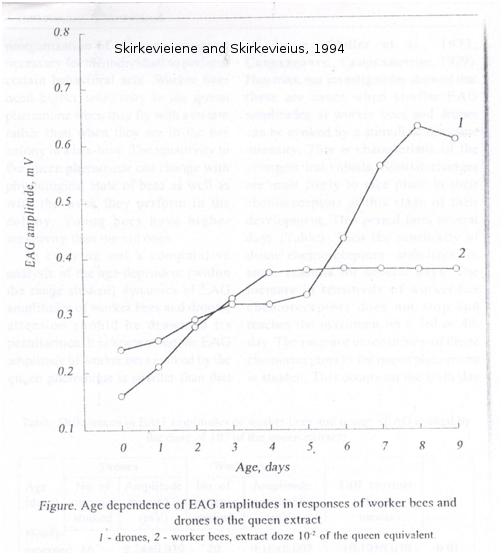
Figure 6 : Réponse électroantennographique d’antennes de mâles et d’ouvrières, en fonction de l’âge, à un extrait de reine. On observe que les mâles détectent significativement mieux une odeur de reine par rapport aux ouvrières à partir du 7ème jour de leur vie. Les antennes des mâles matures sont plus sensibles à l’odeur d’une reine (tiré de Skirkevieiene and Skirkevieius, 1994).
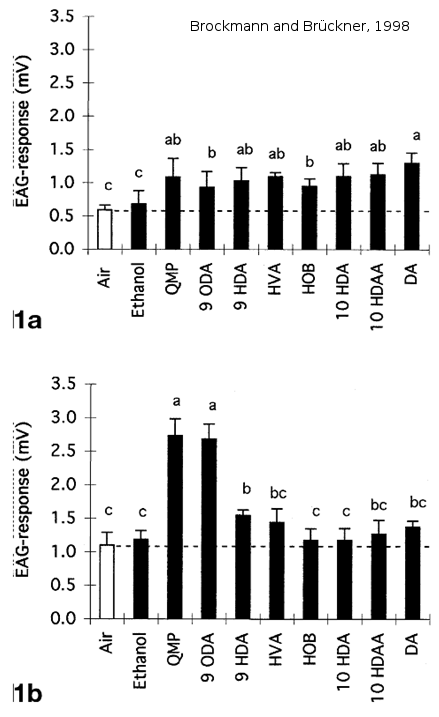
Figure 7: Réponse électroantennographique d’antennes d’ouvrières 1a et de mâles 1b à un extrait de reine. Les antennes de mâles répondent plus fortement à une odeur de QMP et de 9-ODA que les ouvrières. De plus, on observe une réponse significativement plus élevée chez les mâles à des odeurs de QMP et de 9-ODA par rapport à des odeurs contrôles ou à d’autres molécules de la glande mandibulaires de reine (QMP) (tiré de Brockmann and Brückner, 1998).
Les mâles possèdent également au niveau de leur cerveau des adaptations à la détection des reines. En effet, le premier centre de traitement de l’information olfactive chez les insectes, le lobe antennaire, est constitué de nombreuses sous unités appelées glomérules. Un glomérule est une unité morphologique et fonctionnelle à très forte densité synaptique qui permet le traitement olfactif. Certaines espèces possèdent des glomérules hypertrophiés, spécialisés dans la détection des phéromones, appelés macroglomérules. Par exemple, le mâle Apis mellifera possède 4 macroglomérules (MG1 à 4), et parmi ces 4, le macroglomérule MG2 est spécialisé dans la détection du 9-ODA (molécule majoritaire de la phéromone de reine vierge) (Sandoz et al., 2007) (Figure 8).
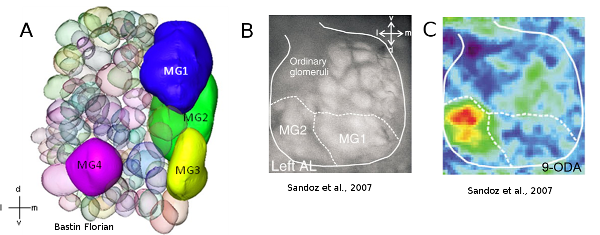
Figure 8: Représentation et activité calcique du lobe antennaire de mâle. 8a) Reconstruction 3-D d’un lobe antennaire droit d’un mâle d’Apis mellifera. Le mâle possède 4 macroglomérules dont le plus important est le MG2. 8b) Expérience d’imagerie calcique sur un lobe antennaire de mâle. La présentation du 9-ODA induit une activité neuronale dans la zone du MG2. Les mâles possèdent une ligne dédiée à la détection de la molécule principale de la phéromone de reine (9-ODA), qui est absente chez les femelles (Bastin Florian en préparation ; Sandoz et al., 2007)
1.2.3. La maturité des mâles
La littérature est très contradictoire en ce qui concerne l’âge de maturité sexuelle des mâles. Beaucoup d’études la placent entre 7 et 9 jours (Drescher 1969 ; Kurennoi 1954 ; Oertel 1956 ; Tofilski et Koppel, 1996). Cependant, une étude contredit ces travaux et suggère que les mâles atteindraient leur maturité sexuelle à l'âge de 12 jours seulement (Ruttner et Ruttner, 1966). Dans cette étude, il est décrit que les vésicules séminales et les glandes à mucus sont encore en développement après le 8ème jour et que la semence mûre du mâle n’est généralement pas disponible avant au moins le 12ème jour. Avant, le sperme est plus ou moins mélangé au mucus, ce qui ne le rend guère propice à l’insémination (Rutner 1976). Les premiers vols des mâles entre 7 et 12 jours seraient des vols d’orientation et de propreté plutôt que des vols nuptiaux, qui, eux, ne commenceraient qu’à partir du 12ème jour (Ruttner et Ruttner 1966). Les apiculteurs qui pratiquent l’insémination artificielle s’orientent sur des mâles encore plus âgés pour être sûrs d’obtenir un sperme mature (environ 17-20 jours). Il ne faut cependant pas utiliser des mâles de plus de 4 semaines. Les reines inséminées avec du sperme de mâles âgés de plus de 4 semaines retiennent de la semence dans leurs oviductes, ce qui peut causer leur mort. Le sperme des mâles change également d’aspect et de couleur. Il passe de fluide et clair à plus sombre et visqueux (Woyke J., Jasinski Z. 1978). Au cours du temps, le sperme se sépare du mucus : au 5ème jour, lors de l’éversion, on retrouve du mucus dans un liquide aqueux, entre le 8ème et le 10ème jour, le sperme très clair est encore mélangé à du mucus, et à partir du 12ème jour, le sperme se sépare du mucus.
1.2.4. Le vol des mâles
1.2.4.1. Durée du vol
Avant de prendre leur envol, les mâles nettoient leurs antennes et leurs yeux la plupart du temps à l’entrée de la ruche, mais ils peuvent aussi effectuer des vols lors d’essaimages (Burgett, 1974). Les faux-bourdons effectuent deux vols distincts : ceux d’orientation et ceux de fécondation. Les vols d’orientation sont courts, d’une durée de 1 à 6 minutes (Howell et Usinger, 1933). Ils aident à localiser la ruche dans l’environnement et servent aussi de vol de propreté car les mâles défèquent pendant celui-ci (Howell et Usinger, 1933). Les vols de fécondation sont effectués par des mâles matures et durent plus longtemps : 32.56 ± 22.49 minutes (Witherell, 1971). Durant ces vols, les mâles visitent les zones de congrégation de mâles et essaient de se reproduire avec une reine. Cependant, seulement 1 mâle sur 200 arrivera à copuler avec une reine et donc 99,5% des mâles présents dans la congrégation meurent sans se reproduire (Koeniger et Koeniger, 2010).
La durée de vol des mâles est limitée par la quantité de miel contenue dans leur jabot. Le poids du jabot d’un mâle à la sortie de la colonie est de 17.7±9.1 mg pour un poids de 4.3±6.3 mg au retour de la congrégation (Free, 1957 ; Burgett, 1973). Durant le pic d’activité de vol des mâles, on retrouve des mâles qui se nourrissent plus et qui ont un jabot plus rempli avant leurs vols de fécondation (Burgett, 1973). Les mâles effectuent plusieurs vols de fécondation, le plus souvent 2 ou 3, mais ils sont capables d’en effectuer jusqu’à 5 en une après-midi (Drescher 1969). Entre deux vols de fécondation, ils passent 17.14 ± 24.42 dans la ruche à se nourrir (Witherell, 1971).
Au retour des congrégations, les mâles ne retournent pas nécessairement dans leurs colonies d’origine (Currier et Jay, 1991). Selon l’étude de Soland-Reckeweg (2006), 42% des mâles marqués en congrégation sont retrouvés dans leur ruche d’origine, 55% des mâles ont dérivé dans une ruche voisine au sein de leur rucher (courte distance) et seulement 3% des mâles se dispersent de leur rucher natal dans un autre rucher plus éloigné. Ainsi, 97% des drones dans les congrégations viennent de colonies à moins de 3000 m de la congrégation (Figure 9), 3% de colonies à plus de 3000 m et aucun mâle ne sont issus de ruchers à plus de 4000 m de la congrégation. Ce résultat est en adéquation avec d’autres études qui montrent que les mâles se rendent dans les congrégations les plus proches de leurs nids (Koeniger et al., 2005).
Les mâles effectuent leurs vols seulement lors de conditions météorologiques favorables, à savoir quand la température est supérieure à 19° (Ruttner 1956 ; Drescher 1969 ; Ruttner 1976, Bol’shakova, 1978) et quand elle ne dépasse pas 38°C (Rowell et al., 1986). L’activité de vol des mâles est réduite quand le vent dépasse 4-6 m/s (Ruttner 1956), et la hauteur des congrégations, entre 10- 40 m au dessus du sol, diminue avec un temps venteux (Ruttner 1966). Le pic d’activité de vol des mâles se situe entre 14h et 17h (Howell et Usinger, 1933 ; Taber, 1964 ; Ruttner, 1966 ; Bol’shakova, 1978 ; Boucher et Schneider 2009), mais celui-ci dépend des conditions météorologiques (Taber, 1964 ; Drescher, 1969 ; Verbeek et Drescher, 1984). Pour des températures hautes, les vols commencent plus tard (Rowell et al., 1986) et sont plus longs (Verbeek et Drescher, 1984). Bien sûr, l’activité de vol des mâles change aussi en fonction de la région géographique.
1.2.4.2. Distance de vol
Koeniger supporte l’idée que les mâles visitent plusieurs congrégations durant leur phase d’orientation pour rester ensuite dans la plus attractive. Observant qu’une congrégation est majoritairement composée de mâles des ruchers les plus proches, il conclut que la distance est un facteur de choix important. Ce choix pourrait avoir comme origine une optimisation de l’énergie dépensée (Koeniger 2004). Cette observation implique que la capture des mâles d’une congrégation est un bon indicateur de la génétique des abeilles d’une zone. La distance moyenne du vol des mâles est de 900m (Taylor 1988).

Figure 9 : Distribution du nombre de mâles dans la congrégation en fonction de la distance à leurs ruches. Les mâles choisissent préférentiellement la congrégation la plus proche (96,6%) alors que seulement 3,4% des mâles parcourent une distance supérieure à 3000 m. Les mâles choisissent les congrégations les plus proches de leurs colonies (tiré de la thèse de Soland-Reckeweg 2006).
Cette préférence pour la congrégation la plus proche peut être expliquée par un coût énergétique important du vol pour le mâle. La consommation d’oxygène pendant le vol des mâles est 2 fois plus grande que celle des ouvrières (Goller et Esch, 1991). Cela est dû certainement à des muscles allaires beaucoup plus développés (Winston 1987). Les mâles ont une température du thorax supérieure aux ouvrières pendant le vol et la force produite durant le vol d’un mâle est plus importante (3.95±0.23 mN) que celui des reines ou ouvrières (Coelho, 1991). Par conséquent, le choix de la zone de congrégation la plus proche permettrait aux drones de rester plus longtemps dans la congrégation et donc d’augmenter leurs chances de s’accoupler (Koeniger et al., 2005b).
Les reines vierges se reproduisent également dans la congrégation la plus proche. Biologiquement, cela semble logique que la reine évite de longs vols dangereux car elle est l’individu indispensable à la survie d’une colonie. Le choix de se reproduire dans les congrégations les plus proches pour les mâles et reines vierges n’engendre pas énormément de consanguinité du fait de la quantité de mâles présents dans la congrégation (plus de 10000). Il est donc peut probable que la reine vierge se reproduise avec un mâle de sa ruche. De plus, celle-ci va se reproduire avec une douzaine de mâles différents, donc une seule copulation consanguine n’entrainera pas une perte de la future colonie.
1.2.5. Les problèmes de fécondité des mâles
La performance de reproduction des mâles peut être affectée par la consanguinité (Moritz 1981) ou une infection au Varroa (Duay et al., 2002). Lorsque la consanguinité de la reine augmente, la durée de vie des mâles, le nombre de spermatozoïdes et la fréquence des vols de fécondation diminuent, et plus le degré de consanguinité d’une reine est importante, plus les mâles effectuent leur 1er vol à un âge précoce (Moritz 1981). Les mâles infectés par Varroa destructor pendant leurs stades de développement montrent une diminution de la production de sperme et de la durée des vols de fécondation (Duayet al.,2002).
2. La formation des congrégations de faux bourdon.
2.1. Localisation spatio-temporelle des congrégations
Les résultats que nous avons présentés dans cet article sont des études effectuées sur l’abeille domestique Apis mellifera. Cette espèce est la plus étudiée par les scientifiques, mais il existe 8 autres espèces d’abeilles dans le genre Apis, que l’on trouve principalement dans l’Asie du sud-est (Oldroyd and Wongsiri, 2006). Ces espèces se regroupent en 3 grands groupes phylogénétiques : les abeilles naines (2 espèces), les abeilles géantes (2 espèces) et les abeilles de cavité (5 espèces). Ces groupes peuvent être différenciés par des caractères comme la taille, la construction du nid et le recrutement par la danse de l’abeille (Koeniger et al., 2010). Cependant, au sein des 9 espèces du genre Apis, on observe la même stratégie de reproduction. Les mâles de différentes colonies se regroupent dans des congrégations et ensuite les reines vierges rejoignent ces congrégations pour se reproduire. Malgré ce comportement très bien conservé au sein du genre Apis, il existe des différences spatio-temporelles dans la formation des congrégations entre les différentes espèces d’abeilles. Ces différences peuvent jouer un rôle de barrière reproductive entre espèces. Les mâles effectuent leurs vols de fécondation dans l’après-midi, allant de midi pour les abeilles naines jusqu’au début de la nuit pour les abeilles géantes (Koeniger et Wijayagunasekera, 1976 ; Rinderer et al., 1993 ; Koeniger et al., 1994 ; Yoshida et al., 1994 ; Wilde et al., 2003 ; Remnant et al., 2014). Les congrégations se forment dans de nombreux lieux différents, des zones dégagées pour Apis mellifera à des zones sous les branches de grands arbres ou de buissons pour Apis dorsata et Apis koschevnikovi (Koeniger et Koeniger 2000 ; Koeniger et al., 2010).
Cependant, il existe des différences au sein d’une même espèce entre différentes régions géographiques, dans l’heure et le lieu des congrégations. Nous allons prendre en exemple l’espèce Apis cerana, mais il existe aussi des variations chez l’espèce Apis mellifera et certainement chez les autres espèces d’Apis qui sont moins étudiées. Au Japon, les congrégations d’A. cerana japonica se forment au-dessus d’arbres proéminents (Yoshida et al., 1994). À Bornéo, A. cerana indica forme des congrégations de mâles dans un espace dégagé à proximité de branches d’arbres où les mâles se replient en cas de perturbation (prédateur) dans la congrégation (Koeniger et Koeniger 2000). Cependant, cette même sous-espèce a été introduite en Allemagne (souche originaire du Nord du Pakistan) et forme ses congrégations de mâles dans des vallées dégagées, éloignées des arbres (Ruttner et al., 1973). Les différences dans ces lieux de congrégation peuvent être dues à des adaptations locales à l’environnement, car la pression de prédateurs (oiseaux) semble plus importante dans un climat tropical que dans les montagnes. Les vols de fécondation pour l’espèce A. cerana se situent entre 12h30 et 17h30 (Koeniger et Wijayagunesekera, 1976 ; Rinderer al., 1993 ; Koeniger et al., 1996). Cependant ceux-ci dépendent de leur région géographique et des autres espèces d’abeilles sympatriques (Tableau 1).
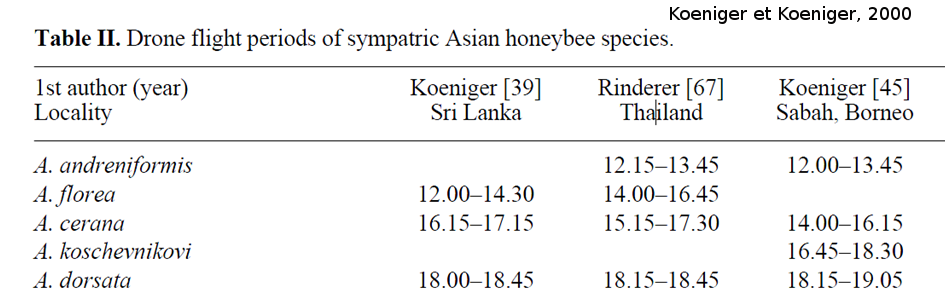
Tableau 1 : Période d’activité de vol des mâles de différentes espèces d’Apis dans différentes régions du monde. Pour chaque région, on observe un gradient de grandeurs, avec l’espèce la plus petite qui vole le plus tôt, suivie des espèces de plus en plus grandes au cours de la journée (tiré de Koeniger et Koeniger, 2000).
La congrégation peut jouer un rôle de barrière reproductive. Il semble donc intéressant de regarder les différences spatio-temporelles des congrégations de mâles dans des situations sympatriques où différentes espèces d’Apis coexistent dans un même lieu. Des études réalisées par l’équipe de Koeniger sur l’île de Bornéo montrent des différences entre les congrégations de mâles d’espèces sympatriques (Koeniger et Koeniger 2000 ; Koeniger et Koeniger 2004 ; Koeniger et al., 2010). L’étude porte sur quatre espèces sympatriques de l’île : une espèce d’abeilles naines (Apis andreniformis), deux espèces d’abeilles de cavité (Apis cerana, Apis koschevnikovi) et une espèce d’abeilles géantes (Apis dorsata). Ces espèces effectuent leurs vols de fécondation à différentes périodes de la journée : en premier les mâles d’Apis andreniformis ont une activité entre 12h et 13h30, ensuite les mâles d’Apis cerana entre 13h30 et 15h, les mâles d’Apis koschevnikovi volent entre 16h30 et 18h et enfin à la tombée de la nuit les mâles d’Apis dorsata entre 18h et 19h (Figure 10). On observe qu’il n’y a pas de chevauchement entre les périodes de reproduction de ces 4 espèces. De plus, les reines de chaque espèce rejoignent les congrégations lors du pic de la période d’activité des mâles. Étonnamment, on observe un gradient de grandeurs avec l’espèce la plus petite qui vole le plus tôt, suivie des espèces de plus en plus grandes au cours de la journée. À notre connaissance, cette observation sur la chronologie des congrégations de mâles des espèces en fonction de la taille est vérifiée sur toutes les régions possédant des espèces sympatriques d’Apis (Sri lanka, Koeniger et Wijayagunasekera 1976 ; Thailand, Rinderer et al 1993 ; Bornéo, Koeniger et al., 1996). Cette même équipe a également observé, sur l’île de Bornéo, des différences dans la localisation des zones de congrégations des différentes espèces (Figure 11). Les congrégations d’Apis cerana se forment dans une zone ouverte dégagée en lisière d’arbres. Les mâles de cette espèce se refugient dans les branches et feuillages en cas de perturbations (prédateurs etc.). Les mâles d’Apis dorsata se regroupent sous les branches d’arbres identifiables par leur grande taille, environ 25 m de hauteur, tandis que l’espèce Apis koschevnikovi forme ses congrégations sous les branches et feuillages de plus petits arbres allant même jusqu’à moins de 1,50 m au-dessus du sol. On ne sait pas comment les drones et les reines vierges trouvent les congrégations chez Apis mellifera, mais cette étude montre qu’il doit exister des indices visuels, comme des grands arbres identifiables. En effet, dans cette étude, les trois espèces forment leurs congrégations de façon très proche (30 m entre chaque) dans une région avec de grands arbres proéminents.
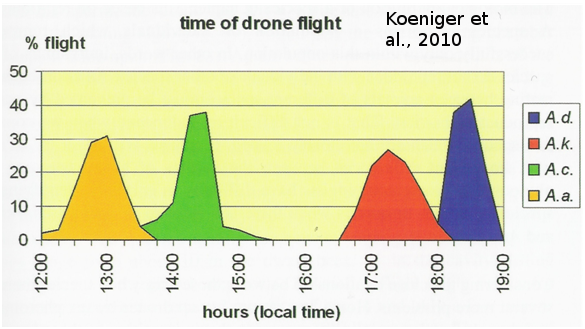
Figure 10 : Période des vols de fécondation des mâles d’espèces sympatriques d’Apis à Sabah (Bornéo). Dans un premier temps les mâles d’A. andreniformis (A.a ; jaune) effectuent leurs vols de fécondation. Ensuite les mâles d’Apis cerana (A.c ; vert) se regroupent principalement entre 14h et 15h. L’espèce A. koschevnikovi (A.k. ; rouge) forme ses congrégations 16h30 et 18h. Et pour finir, l’abeille géante A. dorsata (A.d. ; bleu) se reproduit à la tombée de la nuit (tiré de Koeniger et al., 2010).

Figure 11 : Schéma des congrégations de mâles d’espèces sympatriques d’Apis à Sabah (Bornéo). Les congrégations d’Apis dorsata se forment sous les branches d’arbres émergents les plus grands, Apis koschevnikovi sous les branches d’arbres plus petits et Apis cerana dans une zone dégagée proche d’arbres de taille moyenne. Les trois domaines de congrégation étaient séparés de 30 m entre eux (tiré de Koeniger et al., 2010).
Ces différences spatiales et temporelles des congrégations entre les espèces Apis sont très importantes pour éviter les reproductions croisées. En effet, la phéromone mandibulaire de reine est très proche dans sa composition entre les différentes espèces. Elle est principalement dominée par le 9-ODA, une molécule qui attire les mâles de toutes les espèces d’Apis qui ont été testées à ce jour. Si une reine d’une espèce rentre dans une congrégation d’une autre espèce, les drones vont essayer de se reproduire avec elle. Si la copulation a lieu, l’endophallus étranger pénètre dans le vagin de la reine et reste coincé. La reine ne pouvant expulser l’endophallus, les deux individus tombent au sol et meurent. Voilà pourquoi il est très important d’avoir des différences entre les congrégations des différentes espèces sympatriques.
Il existe aussi des différences entres les sous-espèces d’Apis mellifera pour l’heure de vol de fécondations des mâles, mais celles-ci sont beaucoup plus faibles (Drescher, 1969 ; Tribe, 1982 ; Rowell, 1986 ; Taylor, 1986 ; Hellmich, 1987, Hellmich, 1988 ; Koeniger et al., 1989 ; Hellmich et al., 1991 ; Lahner, 1998 ; Otis et al., 1999 ; Jordan et al., 2007 ; Collet et al., 2009 ). Ces résultats sont difficiles à comparer car effectués à différentes saisons et dans des régions différentes. Pour faciliter les comparaisons, il serait intéressant d’utiliser l’heure solaire (Oldroyd et al., 2006). On peut retrouver deux sous-espèces dans la même congrégation de mâles, mais on observe une distribution verticale des mâles et reines de chaque espèce au sein de la congrégation (Kerr et Bueno, 1970 ; Koeniger et al., 1989). Par exemple, les mâles et reines vierges d’Apis mellifera ligustica volent à plus base altitude que ceux d’Apis mellifera carnica dans la même congrégation (Koeniger et al., 1989). Cependant, cela n’est pas une isolation reproductive complète, même si les mâles et reines vierges se reproduisent préférentiellement entre la même sous-espèce.
2.2. Congrégation et topographie
Les congrégations se forment au même endroit d'une année sur l'autre, et ce sur plusieurs dizaines d'années (Jean-Prost, 1960; Ruttner and Ruttner, 1968; Ruttner, 1985; Koeniger and Koeniger, 2004), bien que l’espérance de vie d'un mâle ne dépasse pas quelques semaines (Fukuda and Ohtani, 1977). La présence d'une reine n'est pas nécessaire pour l’établissement d’une congrégation (Jean-Prost, 1957; Ruttner and Ruttner, 1965; Koeniger and Koeniger, 2004).
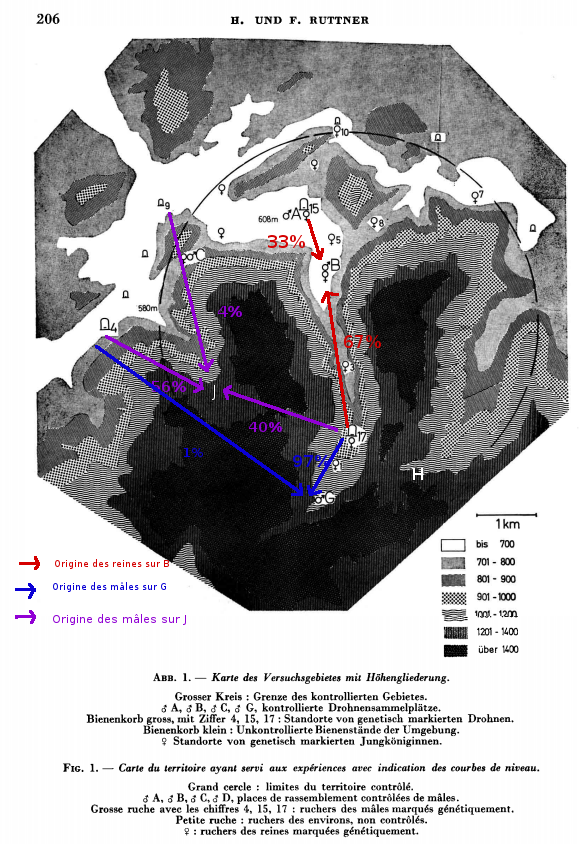
Dans ses articles de 1972 et 1976, Ruttner étudie les mouvements de reines et mâles dans une zone montagneuse. Les congrégations sont appelées J, G et H. Il cherche à étudier la fécondation des reines en fonction du relief. Il remarque que les mâles de la congrégation en hauteur (J : 1200m) viennent des ruchers en contrebas, à une distance de 3km majoritairement. Une faible partie vient des ruchers plus éloignés. Par ailleurs, lorsque la congrégation est dans une dépression (G), les mâles sont majoritairement issus des ruchers de la dépression. Il faut cependant noter que certains mâles sont venus des vallées voisines (4) distantes de 5 à 6,5 km par-dessus les montagnes (1 400 m). Ils ont dû accomplir au cours de leur vol un dénivelé de 800 m. Pour le vol de retour, il leur a fallu s’élever de 300 m supplémentaires, avant de pouvoir planer dans la vallée. Les pans de montagne ne constituent donc pas une barrière pour les accouplements étanches, même lorsqu’ils atteignent une forte hauteur. Les places de rassemblement se trouvent parfois en haut d’un col et les reines et les mâles peuvent y accéder de part et d’autre.Environ 10 % des mâles d’une place de rassemblement peuvent venir d’une distance d’environ 6 km et davantage. Dans ce cas, des pans de montagne de 800 à 1 000 m de hauteur peuvent même être franchis (G); il ne s’agit d’ailleurs pas de mâles « vagabonds » ayant abandonné leur colonie, car dans certains cas, on a pu les retrouver dans leur ruche d’origine après leur retour de la congrégation. Par ailleurs, Ruttner montre aussi que les reines suivent les vallées, mais nous verrons cela dans un article futur. Les mâles préfèrent rester dans les vallées, mais peuvent tout de même parcourir 7km et passer des obstacles de plus de 1000m de haut.
Les mâles ne se rassemblent pas seulement en groupe dans les congrégations, car des couloirs de mâles peuvent se former le long des structures proéminentes, comme les lignes d’arbres. Ces zones où les mâles volent plus bas, à 21m, se ramifient lorsque de nouvelles structures apparaissent dans le paysage. Ces embranchements sont souvent à l’origine de congrégations. Cette observation amène à penser que les congrégations se formeraient à partir de zones où les mâles s’accumulent en changeant de direction et d’altitude pour choisir leur nouveau trajet.
Cependant, la topographie à elle seule ne peut pas expliquer comment les mâles s'orientent à courte distance et comment les limites d'une congrégation peuvent être aussi tranchées : quand une reine quitte une congrégation, les mâles arrêtent rapidement leur poursuite (Ruttner and Ruttner, 1965; Ruttner, 1985; Loper et al. 1992). Toutes ces observations indiquent que les phéromones sont à l’origine de l’interattraction des mâles entre eux. Jusqu'à présent, la manière dont les mâles et les reines vierges trouvent les congrégations n'est pas encore complètement élucidée. L'existence d'une phéromone d’agrégation de mâles a été proposée pour expliquer la formation des congrégations, mais elle n'a pas encore été démontrée (Free, 1987).
2.3. Le rôle des phéromones de mâle
2.3.1 L’existence d’une phéromone de mâle
D’anciennes études sur l’abeille Apis mellifera confortent l’hypothèse d’une phéromone de mâle attractive. Ces études se sont déroulées dans les mêmes conditions que l’étude de Pain et Ruttner en 1963, c'est-à-dire à l’aide d’un leurre envoyé directement dans la congrégation à l’aide de ballons d’hélium (Figure 12). Pour la première étude, Gerig (1972) a tout d’abord montré qu’un broyat de têtes de mâles d’abeilles, présenté au sein de la congrégation, était attractif pour les mâles. Par la suite, une étude s’est intéressée à l’attraction des mâles de congrégation envers des glandes mandibulaires de mâles (Figure 13, Lensky et al., 1985). Pour vérifier leur rôle dans l’attraction, des extraits de 50 glandes mandibulaires ont été fixés sur des gazes absorbantes. Les gazes ont été attachées à des fils de nylon tendus par des ballons d’hélium, se retrouvant ainsi entre 8 et 12 m au-dessus du sol. Un témoin à l’acétone (le solvant des extraits) était également fabriqué de la même manière. Les mâles attirés par les différentes gazes étaient ensuite comptés. Les résultats suggèrent que les mâles sont attirés par un extrait de glande mandibulaire de mâles.

Figure 12 : Comète de mâles attirés par un leurre imbibé de QMP envoyé dans une congrégation à l’aide de ballons d’hélium (photo : équipe EVOLBEE, congrégation du rucher de Rochefort).
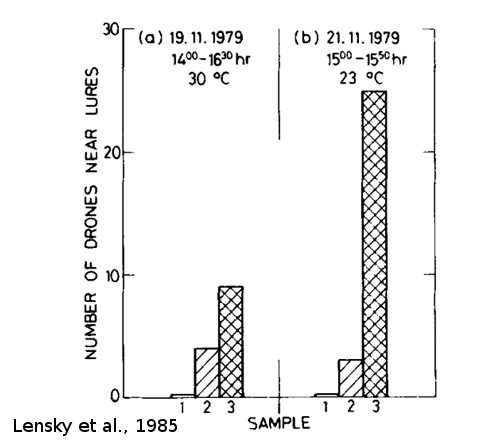
Figure 13 : Attraction des mâles (Apis Mellifera) envers des glandes mandibulaires (extraites de mâles matures) et des têtes séparées de leur glandes mandibulaires, avec ou sans lanoline (a et b). Dans l’ordre : 1 = témoin, 2 = tête, 3 = glande mandibulaire de mâle (tiré de Lensky et al., 1985).
Jusqu’à récemment, les travaux de Gerig (1972) et de Lensky et al. (1985) étaient restés sans suite, de sorte que la phéromone potentielle de mâles n’a jamais été identifiée. La plupart des expériences menées sur l’attractivité d’odeurs sur les mâles ont souffert du manque d'accessibilité des congrégations, qui se situent haut dans le ciel. Les études précédentes ont utilisé des ballons d’hélium pour présenter des stimuli aux mâles dans les congrégations (Gary, 1962, Gerig 1972, Lensky et al., 1985 ), mais ces études sont compliquées à mettre en place et les conditions expérimentales sont difficiles à contrôler. C’est pourquoi, dans le laboratoire EGCE (CNRS de Gif-sur-Yvette), l’équipe EVOLBEE a établi un protocole d'analyse en laboratoire permettant d'étudier les préférences des mâles dans des conditions strictement contrôlées. Ce protocole est basé sur un simulateur de marche proposant un test de choix olfactif aux animaux (Brandstaetter et al., 2014) (Figure 14). Ainsi, l’insecte testé a le contrôle sur la libération des stimuli olfactifs et peut choisir de se trouver dans une zone libérant ou non ces stimuli. Les substances testées sont : QMP, 9-ODA, des groupes de 10 ouvrières et des groupes de 10 mâles supposés sexuellement matures (mâles ‘tout-venant’ d’extérieur, prélevés sur la planche d’envol des ruches). On mesure le temps passé par le mâle dans le quadrant odeur. Les résultats montrent clairement une attirance des mâles pour le 9-ODA et non pour la QMP. Dans cette expérience, la QMP (non attractive) représente l’odeur d’une reine fécondée et le 9-ODA (attractif) se rapproche plus d’une odeur de reine vierge. D’un point de vue adaptatif, il est bénéfique pour les mâles de différencier une odeur de reine fécondée de celle d’une reine vierge, pour optimiser ses chances de reproduction. L’expérience montre aussi que les mâles testés sont également attirés par un groupes de mâles (Brandstaetter et al., 2014). Ces résultats confirment l’hypothèse de la production par les mâles de potentielles phéromones qui pourraient jouer un rôle dans la formation des congrégations. Il reste toutefois encore à trouver la molécule responsable de cette interattraction entre les mâles.
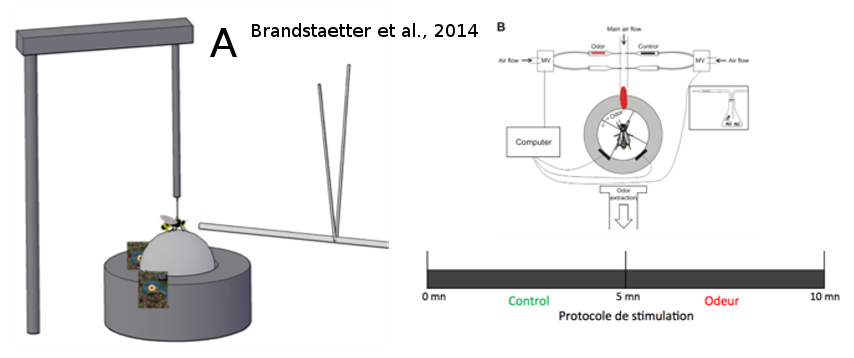
Figure 14: Simulateur de marche. Le mâle est fixé au-dessus d’une balle sur coussin d’air sur laquelle il peut marcher librement. Les mouvements de la balle sont enregistrés grâce à deux capteurs optiques, ce qui permet de reconstituer le parcours de l'abeille. Les odeurs sont présentées à l'abeille par un flux d'air constant dirigé face à l'insecte. La balle est divisée en quatre quadrants virtuels, dont l’un est choisi comme étant le quadrant lié à l'odeur. Après une période d'acclimatation de cinq minutes sans stimulus, le contrôle des stimuli est donné à l'abeille pendant cinq minutes : quand l'abeille se dirige en direction du quadrant lié à l'odeur, le stimulus olfactif est déclenché grâce à des valves magnétiques (reliées à l'ordinateur). Le temps passé par l’insecte dans le quadrant odeur permet de quantifier son attraction envers l'odeur (tiré de Brandstaetter et al., 2014).
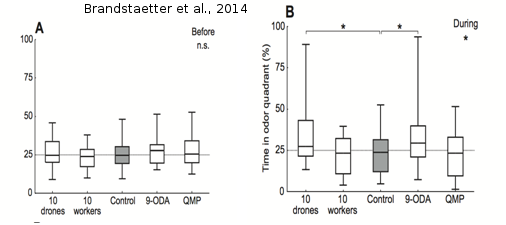
Figure 15 : Test d’attraction : boxplots montrant la médiane du temps passé par les mâles dans le quadrant « stimulé » avant (A) et pendant (B) l’accès au stimulus. On n’observe pas de différences significatives entre les différents groupes dans les mesures effectuées avant et après l’accès au stimulus. Quand le stimulus olfactif est disponible (période pendant), on observe que les mâles testés avec du 9-ODA et un groupe de 10 mâles passent significativement plus de temps dans le quadrant odeur que ceux du groupe contrôle (tiré de Brandstaetter et al., 2014).
2.3.2. L'organe de sécrétion de la phéromone mâle
Les glandes mandibulaires sont importantes et jouent de nombreux rôles dans la biologie des insectes. Déjà, des phéromones d’agrégation de mâles ont été identifiées dans les glandes mandibulaires de plusieurs espèce d'hyménoptères (Ayasse et al., 2001). Les résultats suggèrent que ce seraient bien les glandes mandibulaires qui sont la source d’attraction des mâles et que celles-ci sécrèteraient donc une molécule attractive pour les autres mâles (Lensky et al., 1985). Cependant, les glandes mandibulaires des mâles sont très réduites par rapport à celles des reines et des ouvrières (Winston, 1987) (Figure 16). De plus, le développement des glandes mandibulaires des mâles atteint son maximum entre 7 et 9 jours, avant de s’atrophier (Lensky et al., 1985). Les glandes mandibulaires sont donc absentes chez les mâles matures, mais d’après Lensky et al. (1985), la production des glandes mandibulaires est stockée dans le lumen de la glande jusqu’à ce qu’elle soit libérée lors du vol nuptial.
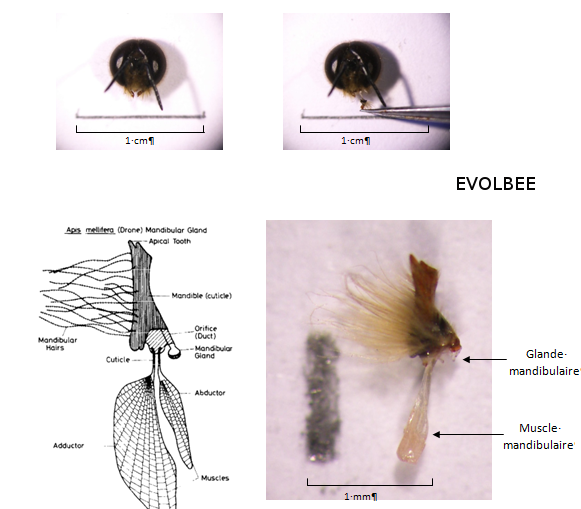
Figure 16 : Schéma et photo d’une mandibule et de la glande mandibulaire de mâle (Apis mellifera). Chez le mâle, les glandes mandibulaires sont beaucoup plus petites que chez la reine et elles disparaissent lorsqu’ils deviennent matures. Cependant, leurs sécrétions restent stockées dans le lumen (Schéma : Lensky et al., 1985 ; Photo : Equipe EVOLBEE).
L’attractivité des glandes mandibulaires des mâles envers d’autres mâles doit être vérifiée en laboratoire. En ce moment, l’équipe EVOLBEE réalise des tests d’attractivité sur différentes parties du corps des mâles, en particulier les glandes mandibulaires. Une fois l’organe source de la sécrétion découvert, des extraits de celui-ci seront analysés en GC-MS (chromatographie en phase gazeuse liée à un spectromètre de masse) afin d’identifier les molécules qui composent la phéromone. À la manière du 9-ODA chez la reine vierge, une recherche de la molécule attractive pour les mâles sera effectuée à l’aide du simulateur de marche. Enfin, il sera intéressant d’étudier son traitement nerveux par le système olfactif des mâles (un macroglomérule ?) grâce à la technique d’imagerie calcique in vivo développée par l’équipe.
Conclusion:
L’étude de la formation des congrégations chez l’abeille va permettre de mieux comprendre et de contrôler la reproduction des différentes espèces d’abeilles, ce qui va améliorer les stratégies apicoles dans les projets de conservation et de sélection de l’abeille. Les études sur ces congrégations sont peu nombreuses, car l’accessibilité des congrégations est compliquée et l’étude sur les mâles et les reines est plus coûteuse. Une phéromone d’agrégation des mâles issue des glandes mandibulaires semble être une bonne hypothèse pour la formation des congrégations. Mais il reste encore des choses à découvrir, comme les signaux permettant la stabilité des congrégations d’année en année.
Cet article a été écrit avec Florian Bastin, Thibault Chaumont et Jean-Christophe Sandoz de l’équipe EVOLBEE du laboratoire Évolution, Génomes, Comportement et Ecologie du CNRS de Gif-sur-Yvette.
Pour aller plus loin:
Qu'est ce que le comportement VSH ?
Qu'est ce que le comportement hygiénique ?
Bibliographie:
Ayasse, M., Paxton, R. J. and Tengö, J. (2001). Mating behavior and chemical communication in the order Hymenoptera. Annu. Rev. Entomol. 46, 31–78.
Baer, B. (2005). Sexual selection in Apis bees. Apidologie 36, 187–200.
Baudry, E., Solignac, M., Garnery, L., Gries, M., Cornuet, J. and Koeniger, N. (1998). Relatedness among honeybees (Apis mellifera) of a drone congregation. Proc. R. Soc. Lond. B. 265, 2009–2014.
Bol'shakova M.D. (1978). The flight of honey bee drones, Apis mellifera L. (Hymenoptera, Apidae), to the queen in relation to various ecological factors. Entomological Review 56:53-56.
Boucher M., Schneider S.S. (2009). Communication signals used in worker–drone interactions in the honeybee, Apis mellifera. Animal Behaviour 78:247–254.
Brandstaetter, A. S., Bastin, F., Sandoz, J. C. (2004). Honeybee drones are attracted by groups of consexuals in a walking simulator. J. Exp. Biol. 217, 1278-1285.
Brockmann, A., Dietz, D., Spaethe, J. and Tautz, J. (2006). Beyond 9-ODA: sex pheromone communication in the European honey bee Apis mellifera L. J. Chem. Ecol. 32, 657–67.
Brockmann, A., Brückner, D. and Crewe, R. M. (1998). The EAG response spectra of workers and drones to queen honeybee mandibular gland components: the evolution of a social signal. Naturwissenschaften 85, 283–285.
Burgett D.M. (1973). Drone engorgement in honey bee swarms. Annals of the Entomological Society of America 66:1005–1006.
Burgett D.M. (1974). Drone honey bee flight from clustered swarms. Annals of the Entomological Society of America 67:683–684.
Collet T., Cristino A.S., Quiroga C.F.P., Soares A.E.E., Del Lama M.A. (2009). Genetic structure of drone congregation areas of Africanized honeybees in southern Brazil. Genetics and Molecular Biology 32:857–863.
Coelho J.R. (1991). The effect of thorax temperature on force production during tethered flight in honeybee (Apis mellifera) drones, workers, and queens. Physiological Zoology 64:823–835.
Currie R.W., Jay S.C. (1991). Drifting behaviour of drone honey bees (Apis mellifera L.) in commercial apiaries. J. Apic. Res 30:61–68.
Drescher W. (1969). Die Flugaktivität von Drohen der Rasse (Apis mellifica carcia L. und Apis mellifica L.) in Abhängigkeit von Lebensalter und Witterung. Z. Bienforsch. 9, 390-409.
Duay P., DeJong D., Engels W. (2002). Decreased flight performance and sperm production in drones of the honey bee (Apis mellifera) slightly infested by Varroa destructor mites during pupal development. Genet. Mol. Res 1:227–232.
Esslen, J. and Kaissling, K. E. (1976). Zahl und Verteilung antennaler Sensillen bei der Honigbiene (Apis mellifera L.). Zoomorphologie 83, 227–251.
Free J.B. (1957). The food of adult drone honeybees (Apis mellifera). British Journal of Animal Behaviour 5:7-11.
Free, J. B. (1987). Pheromones of social bees. Ithaca, New York: Comstock.
Free, J. B. Williams, I. H. (1975). Factors determining the rearing and rejection of drones by the honeybee colony. Anim. Behav. 23, 650-675.
Fukuda, H. and Ohtani, T. (1977). Survival and life span of drone honeybees. Res. Popul. Ecol. 19, 51–68.
Gary, N. E. (1962). Chemical mating attractants in the queen honey bee. Science 136, 773–4.
Gerig, L. (1972). Ein weiterer Dufstoff zur Anlockung der Drohnen von Apis mellifera. Z. angew. Entomol. 70, 286–289.
Goller F., Esch H.E. (1991). Oxygen consumption and flight muscle activity during heating in workers and drones of Apis mellifera. Journal of Comparative Physiology B: Biochemical, Systemic, and Environmental Physiology 161:61–67.
Gries, M. and Koeniger, N. (1996). Straight forward to the queen: pursuing honeybee drones (Apis mellifera L.) adjust their body axis to the direction of the queen. J. Comp. Physiol. A 179, 539-544.
Hellmich R.L. (1987). Flight time differences between Africanized and European drones: implications for controlling matings. American Bee Journal 127:846.
Hellmich R.L. (1988). Flight time differences between Africanized and European drones. Int. Conf. Apic. Trop. Climates, Cairo, pp. 478-480.
Hellmich R.L., Rinderer T.E., Danka R.G., Collins A.M., Boykin D.L. (1991). Flight times of Africanized and European honey bee drones (Hymenoptera: Apidae). Journal of Economic Entomology 84:61–64.
Howell D.E., Usinger R.L. (1933). Observations on the flight and length of life of drone bees. Ann. Entomol. Soc. Amer. 26:239-246.
Hoover, S. E. R., Keeling, C. I., Winston, M. L. and Slessor, K. N. (2003). The effect of queen pheromones on worker honey bee ovary development. Naturwissenschaften 90, 477–80.
Jean-Prost, P. (1957). Observation sur le vol nuptial des reines d’abeilles. Acad. Sci. 245, 2107–2110.
Jean-Prost, P. (1960). L’Apiculture méridionale; ses bases, ses techniques, en 20 leçons. 2nd editio. Hyères.
Jordan L.A., Allsopp M.H., Oldroyd B.P., Wossler T.C., Beekman M. (2007). A scientific note on the drone flight time of Apis mellifera capensis and A. m. scutellata. Apidologie 38:436–437.
Kerr W.E., Bueno D. (1970). Natural crossing between Apis mellifera adansonii and Apis mellifera ligustica, Evolution 24 145–148.
Koeniger, N., Koeniger, G., Gries, M., Tingek, S., & Kelitu, A. (1996). Reproductive isolation of Apis nuluensis Tingek, Koeniger and Koeniger, 1996 by species-specific mating time. Apidologie, 27(5), 353-359.
Koeniger, N. and Koeniger, G. (2004). Mating behavior in honey bees (Genus Apis). TARE 7, 13–28.
Koeniger, N., Koeniger, G., Gries, M. and Tingek, S. (2005). Drone competition at drone congregation areas in four Apis species. Apidologie 36, 211–221.
Koeniger, N., Koeniger, G. and Pechhacker, H. (2005b). The nearer the better Drones (Apis mellifera) prefer nearer drone congregation areas. Insectes Soc. 52, 31–35.
Koeniger G., Koeniger N., Pechhacker H., Ruttner F., Berg S. (1989). Assortative mating in a mixed population of European honeybees, Apis mellifera ligustica and Apis mellifera carnica. Insectes sociaux 36:129–138.
Koeniger G., Koeniger N., Tingek S. (1994). Crossfostered drones ofApis cerana (Fabricius, 1793) andApis koschevnikovi (Buttel-Reepen, 1906) fly at their species specific mating times. Insectes Sociaux 41:73–78.
Koeniger, N., Koeniger, G. and Tingek, S. (2010) Honey Bees of Borneo. Exploring the Centre of Apis Diversity. Natural History Publications. Kota Kinabalu, Borneo, 262 P.
Koeniger N., Wijayagunasekera H.N.P. (1976). Time of drone flight in the three Asiatic honey bee species (Apis cerana, Apis florea, Apis dorsata). J. Apic. Res. 15:67-71.
Kurennoi N. M. (1954). When are drones sexually mature ? Pchelovodsto 30, 28-32.
Lahner G. (1998). Untersuchungen zur Paarungsbiologie der Honigbiene (Apis mellifera L.) des Nyika- Massivs in Malawi, Südostafrika, Dissertation am Fachbereich Biologie der Universität Frankfurt am Main
Lensky, Y., Cassier, P., Notkin, M., Delorme-Joulie, C. and Levinsohn, M. (1985). Pheromonal activity and fine structure of the mandibular glands of honeybee drones (Apis mellifera L.) (Insecta, Hymenoptera, Apidae). J. Insect. Physiol. 31, 265–276.
Loper, G. M., Wolf, W. W. and Taylor, O. R. (1987). Detection and monitoring of honeybee drone congregation areas by radar. Apidologie 18, 163–172.
Loper, G. M., Wolf, W. W. and Taylor, O. R. (1992). Honey-bee drone flyways and congregation areas - radar oberservations. J. Kansas Entomol. Soc. 65, 223–230.
Loper, G. M., Wolf, W. W. and Taylor, O. R. (1993). Radar detection of drones responding to honeybee queen pheromone. J. Chem. Ecol. 19, 1929–1938.
Menzel, R. (1999). Memory dynamics in the honeybee. J. Comp. Physiol. A 185, 323–340.
Menzel, R. (2012). The honeybee as a model for understanding the basis of cognition. Nat.
Rev. Neurosci. 13, 758–768.
Moritz R.F.A. (1981). Der Einfluss der Inzucht auf die Fitness der Drohnen von Apis mellifera carnica. Apidologie 12:41-55.
Morse, R. A., Strong, G. E., Nowakowski, J. (1967). Fall death rate of drone honey bees. J. econ. Ent. 60, 1192-1202.
Oertel, E. (1956). Observations on the flight of drone honeybees. A. Ent. Soc. Am. 49, 497-500.
Ohtani, T. (1974). Behavior repertoire of adult drone honeybee within observation hives. J.








